Bloqueo del trĂĄnsito depresivo
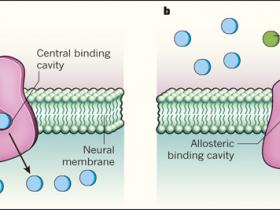
Los transportadores de serotonina son proteĂnas integrales de membrana capaces de recaptar este neurotransmisor desde el espacio sinĂĄptico hacia el interior de las cĂŠlulas. Este fenĂłmeno celular, se relaciona con casos de cuadros depresivos y variados trastornos neurolĂłgicos. Los avances en esta materia son el reflejo de anĂĄlisis estructurales de estas proteĂnas transportadoras, lo que ha permitido identificar un sitio de uniĂłn a fĂĄrmacos que compiten con la serotonina, evitando el reingreso del neurotransmisor y aumentando su disponibilidad durante la sinapsis. Interesantemente, estas molĂŠculas, conocidas como inhibidores selectivos de recaptaciĂłn de serotonina, ademĂĄs pueden acoplarse a un segundo sitio - denominado alostĂŠrico- presente en el transportador. Esta uniĂłn, permite aumentar la afinidad del fĂĄrmaco asociado al sitio principal y como consecuencia, potenciar el efecto inhibitorio. Estos enfoques basados en la biologĂa estructural de proteĂnas tan relevantes, ofrecen nuevas oportunidades terapĂŠuticas para las complicaciones del sistema nervioso central.
Transportador de serotonina
En un reciente artĂculo, Jonathan A. Coleman y colaboradores (Nature. 2016 Apr 21;532(7599):334-9) describieron la primera estructura de alta resoluciĂłn del transportador de serotonina (SERT). Esta proteĂna, recaptura molĂŠculas de serotonina que han sido liberadas por la cĂŠlula y, de esta forma, modula los efectos de este importate neurotransmisor en neuronas vecinas. Quienes no estĂŠn familiarizados con SERT podrĂan preguntarse si determinar su estructura molecular es algo relevante. En primer lugar, es tĂŠcnicamente un desafĂo purificar grandes cantidades de SERT requeridas para el anĂĄlisis estructural. En segundo lugar, la visualizaciĂłn de la estructura molecular detallada de una proteĂna de este tipo, podrĂa proporcionar oportunidades sin precedentes para desarrollar terapias mĂĄs selectivas y eficaces para enfermedades como la depresiĂłn.
Los neurotransmisores serotonina, dopamina y noradrenalina son liberados desde neuronas particulares y cruzan la hendidura sinĂĄptica para unirse a los receptores de neuronas vecinas, en las que modulan los efectos de seĂąales inhibitorias o excitatorias de otros neurotransmisores. El SERT, junto con los transportadores de dopamina (DAT) y de noradrenalina (NET), pertenece a la familia de proteĂnas de transporte de neurotransmisores sodio symporter (NSS), que a su vez es parte de la segunda mayor clase de proteĂnas integrales de membrana en mamĂferos. Es decir, proteĂnas que movilizan iones, pequeĂąas molĂŠculas y nutrientes dentro y fuera de las cĂŠlulas. Los SERT, DAT y NET son expresados selectivamente en la superficie de neuronas presinĂĄpticas y, mediante la recaptaciĂłn de serotonina, dopamina y noradrenalina de vuelta a la cĂŠlula, actĂşan terminando los efectos moduladores de tales neurotransmisores.
Estudios de silenciamiento gĂŠnico realizados hace casi 20 aĂąos, muestran que los tres transportadores desempeĂąan un rol esencial en el mantenimiento diario del control de la seĂąalizaciĂłn neuronal. Su relevancia se ha destacado, ademĂĄs, por el descubrimiento de mutaciones raras en genes codificantes para tales proteĂnas transportadoras, anomalĂas que se han vinculado a enfermedades como el autismo, el trastorno de hiperactividad con dĂŠficit de atenciĂłn (THDA) y Parkinson.
Drogas como la cocaĂna, las anfetaminas y el ĂŠxtasis, ejercen su acciĂłn psicoestimulante por medio del secuestro de las proteĂnas transportadoras. Por otro lado, medicamentos que se dirigen a SERT, NET y DAT, son utilizados para tratar la depresiĂłn y el TDAH, entre otras condiciones. Los antidepresivos, incluyendo los inhibidores selectivos de la recaptaciĂłn de serotonina (ISRS) y los de noradrenalina y serotonina (IRSN), bloquean los transportadores, evitando la recaptaciĂłn del neurotransmisor y, por lo tanto, aumentan su disponibilidad y actividad global en la sinapsis. En teorĂa, asĂ es cĂłmo los ISRS y los IRSN alivian algunos de los sĂntomas de la depresiĂłn y otras condiciones relacionadas con el estado de ĂĄnimo.
En 2005, el grupo que lleva a cabo los estudios actuales, determinĂł la estructura de LEUT, un pariente bacteriano de SERT. El transportador de leucina (LEUT) participa en la absorciĂłn de nutrientes en estos organismos unicelulares y funciona de manera similar a SERT. En 2013, los investigadores tambiĂŠn identificaron la estructura de DAT en la mosca de la fruta. Este estudio sugiere que la organizaciĂłn estructural de estas proteĂnas es altamente conservada evolutivamente, y por otro lado, define elementos estructurales que indican que el mecanismo por el que los NSS transportan sustratos tambiĂŠn es conservado. Al proporcionar conocimientos moleculares sobre la estructura del SERT en humanos, el presente estudio confirma que la naturaleza, cuando encuentra una manera de hacer algo, lo hace una y otra vez. Pero en el caso de SERT, existe un interesante giro a este fenĂłmeno.
Para identificar estructuras en alta resoluciĂłn usando cristalografĂa de rayos X, las proteĂnas deben ser purificadas en grandes cantidades. Las proteĂnas transmembrana son notoriamente difĂciles de purificar, porque son inestables una vez retiradas del ambiente hidrĂłfobo de la bicapa lipĂdica. Previamente, las proteĂnas de membrana se estabilizaban con ĂŠxito mediante la introducciĂłn de mutaciones, induciendo la formaciĂłn de un complejo con proteĂnas fĂĄcilmente cristalizables, o incluso mediante el desarrollo de anticuerpos para la estabilizaciĂłn de las proteĂnas nativas. Coleman y sus colegas, utilizaron un escaneo cuidadosamente elaborado para identificar unos pocos residuos de aminoĂĄcidos que podrĂan ser mutados para estabilizar al SERT, para purificarlo sin afectar sus propiedades funcionales. Los cristales resultantes, revelaron que mĂĄs de 600 residuos aminoacĂdicos de SERT se enhebran unas 12 veces a travĂŠs de la membrana para formar una estructura 3D diseĂąada para mediar el transporte de neurotransmisores acoplados a iones.
Los autores utilizaron cristalografĂa de rayos X para determinar las estructuras del SERT unidos a dos ISRS: paroxetina y escitalopram (el S-enantiĂłmero de citalopram). Encontraron una molĂŠcula de paroxetina unida fuertemente en el centro de la cavidad del SERT, localizada profundamente dentro de la membrana plasmĂĄtica. Como consecuencia, se bloquea competitivamente el transporte de serotonina. Sin embargo, dos molĂŠculas de escitalopram se unen al SERT: una, como la paroxetina, lo realiza con una alta afinidad de la cavidad central, y la segunda mĂĄs libremente en un vestĂbulo orientado hacia el exterior (fig. 1).
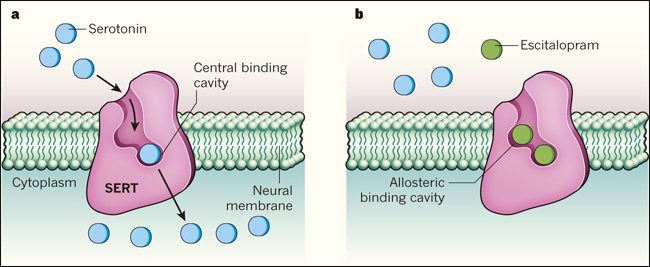
Figura 1. Bloqueo antidepresivo de una proteĂna transportadora.
a, La molĂŠcula neurotransmisora, serotonina, es captada por las neuronas mediante la proteĂna transportadora de serotonina (SERT), a travĂŠs de una uniĂłn de alta afinidad en una cavidad central. b, Coleman y colegas identificaron las estructuras del SERT unidas a dos antidepresivos: paroxetina o escitalopram (sĂłlo se muestra escitalopram). Ambos fĂĄrmacos se unen a la cavidad central, bloqueando el transporte de serotonina, al competir con el neurotransmisor por el sitio de uniĂłn. Escitalopram tambiĂŠn se une en un segundo sitio, denominado alostĂŠrico, que se cree que prolonga la uniĂłn en el sitio central, mejorando la eficacia del bloqueo farmacolĂłgico del SERT.
La existencia de un segundo sitio de uniĂłn (conocido como alostĂŠrico) aparte del principal, se propuso hace mĂĄs de 30 aĂąos. En 2012, el modelado y experimentos de mutaciĂłn, sugirieron que el sitio se encuentra orientado hacia el exterior, tal como Coleman y colegas confirman. Los estudios previos sugirieron que, cuando estĂĄ presente en concentraciones suficientemente altas, la uniĂłn de escitalopram en el sitio alostĂŠrico, podrĂa retardar notablemente la disociaciĂłn de fĂĄrmacos unidos al sitio de alta afinidad - prolongando asĂ la actividad inhibitoria del medicamento. Este fenĂłmeno "modificador alostĂŠrico positivo" se ha propuesto para explicar la superior eficacia clĂnica del escitalopram en comparaciĂłn con otros ISRS, pero confirmar tal mecanismo en estudios con animales ha sido difĂcil. A pesar de esto, la documentaciĂłn molecular acerca del sitio alostĂŠrico es de gran relevancia dado que su estructura podrĂa proporcionar oportunidades no apreciadas previamente para el desarrollo de fĂĄrmacos selectivos.
La presencia de sitios alostĂŠricos en proteĂnas de membrana podrĂa ser mĂĄs comĂşn de lo previsto. Un ejemplo de la potencialidad de este hallazgo proviene de los receptores acoplados a proteĂna G (GPCR, por sus siglas en inglĂŠs) - proteĂnas de membrana que unen serotonina, dopamina, noradrenalina, y muchas otras molĂŠculas de seĂąalizaciĂłn en neuronas postsinĂĄpticas. La determinaciĂłn exitosa de las estructuras de mĂĄs de dos docenas de estos receptores ha posibilitado el hallazgo de muchos sitios de uniĂłn alostĂŠricos potenciales que estĂĄn siendo aprovechados para desarrollar modificadores positivos o negativos de seĂąalizaciĂłn para combatir enfermedades. La misma oportunidad ahora podrĂa presentarse para los transportadores. La visualizaciĂłn de la dinĂĄmica funcional de estas proteĂnas, junto con el modelado molecular de uniĂłn de diferentes fĂĄrmacos, ofrece oportunidades sin precedentes para el desarrollo de mejores tratamientos para los trastornos del sistema nervioso central.
Fuente bibliográfica
Structural Biology: Antidepressants at work
Marc G. Caron & Ulrik Gether
Departments of Cell Biology, Medicine and Neurobiology, Duke University Medical Center, Durham, North Carolina 27710, USA.
doi:10.1038/nature17883
Temas Relacionados