Foco terapÃĐutico: exosomas en el cÃĄncer
El papel de los exosomas en el desarrollo del cÃĄncer se ha convertido en el objetivo de muchas investigaciones, debido a los variados roles emergentes que poseen tales estructuras. Se ha encontrado que estas micro-vesÃculas que se liberan de forma ubicua en el medio extracelular son capaces de regular la funciÃģn del sistema inmune, particularmente en la tumorigÃĐnesis, asà como de acondicionar futuros sitios metastÃĄsicos para la uniÃģn y el crecimiento de tejido tumoral. A travÃĐs de una interacciÃģn con una gran gama de tejidos del huÃĐsped, los exosomas son capaces de generar un entorno pro-tumor que es esencial para la carcinogÃĐnesis final.
La formaciÃģn metastÃĄsica requiere exosomas
Los exosomas son pequeÃąas vesÃculas ricas en ÃĄcidos nucleicos y proteÃnas, y son liberadas desde las cÃĐlulas. Originalmente no tenÃan significado biolÃģgico, pero ahora, estas ampollas de tamaÃąo nanomÃĐtrico son consideradas mini-mapas de sus cÃĐlulas de origen, con relevancia fisiolÃģgica y patolÃģgica. En el cÃĄncer, se han implicados en la modulaciÃģn de la comunicaciÃģn de cÃĐlula a cÃĐlula y en la transferencia de informaciÃģn "indeseable" de una cÃĐlula a otra. Las consecuencias incluyen la estimulaciÃģn de la proliferaciÃģn, motilidad y las propiedades invasivas de la cÃĐlula receptora, la transferencia de resistencia a los medicamentos, induciendo la formaciÃģn de tÚbulos endoteliales (por ejemplo, en la angiogÃĐnesis), y la atracciÃģn de cÃĐlulas cancerosas a sitios secundarios dentro de los organismos vivos. Dicho esto, nuestra comprensiÃģn al respecto es rudimentaria.
Varios estudios demuestran que los exosomas derivados de cÃĐlulas cancerosas son mini-fÃĄbricas dinÃĄmicas que contribuyen activamente a la progresiÃģn de la enfermedad. Estos ensayos se han centrado en su contenido de microARN (miARN). Los miRNAs son pequeÃąos fragmentos de ARN, de doble cadena, que se generan a partir de precursores (pre-miRNA). No codifican proteÃnas, pero sà regulan los niveles de expresiÃģn de conjuntos especÃficos de ARN mensajeros (ARNm), y por lo tanto sus productos proteicos, mediante mecanismos que incluyen la uniÃģn a estos ARNm y su degradaciÃģn. Este proceso de uniÃģn y degradaciÃģn requiere que el pre-miARN sea incorporado en un complejo multiproteico denominado complejo de silenciamiento inducido por ARN. Dentro de este, los pre-miARN maduran en miARN por medio de su interacciÃģn con dos proteÃnas: la enzima Dicer y la proteÃna de uniÃģn a ARN en respuesta a trans-activaciÃģn (TRBP). Por Último, la proteÃna argonauta 2 (AGO2) se une a un miARN y lo guÃa a su ARNm complementario.
Comenzando con exosomas de lÃneas celulares de cÃĄncer de mama y lÃneas de cÃĐlulas de mama no tumorigÃĐnicas (humano, MCF-10A; ratÃģn, NMuMG), Sonia A. Melo y colaboradores (Cancer Cell 2014; 26: 707-21) encontraron que los exosomas derivados de lÃneas cancerÃgenas, y no de cÃĐlulas de mama no tumorigÃĐnicas, estaban enriquecidos con miARN y que los exosomas de cÃĐlulas cancerosas podrÃan convertir pre-miARN en miARN maduros. Ellos cultivaron exosomas de ambos tipos de cÃĐlulas por separado durante 3 dÃas y supervisaron la conversiÃģn de seis pre-miARN en miARN (incluyendo dos miARN especÃficos relevantes para la biologÃa del cÃĄncer de mama, miR-10b y miR-21). En exosomas derivados de lÃneas celulares de cÃĄncer de mama, la relaciÃģn de los genes miARN/pre-miARN aumentÃģ con el tiempo, indicando la presencia de una formaciÃģn activa de miARN. Los investigadores no detectaron un cambio en esta relaciÃģn en los exosomas derivados de cÃĐlulas de mama no tumorigÃĐnicas. AdemÃĄs, el grupo introdujo pre-miARN sintÃĐticos en exosomas de cÃĐlulas cancerosas; estos se convirtieron a miARN en el mismo marco de tiempo. TambiÃĐn se detectÃģ a Dicer, TRBP y AGO2 en exosomas derivados sÃģlo de cÃĐlulas de cÃĄncer de mama.
Para probar el efecto de los contenidos exosomales sobre las cÃĐlulas normales, los autores expusieron cÃĐlulas MCF-10A a exosomas derivados de cÃĐlulas de cÃĄncer de mama MDA-MB-231, y se cultivaron durante un perÃodo de 3 dÃas, aumentando la supervivencia y proliferaciÃģn celular. Este efecto fue acompaÃąado por una disminuciÃģn de la expresiÃģn de la proteÃna supresora de tumores PTEN y el factor de transcripciÃģn HOXD10, que inhibe la expresiÃģn de genes que promueven la invasiÃģn, migraciÃģn y la progresiÃģn del tumor. Los investigadores observaron entonces que las cÃĐlulas no tumorigÃĐnicas, cuando se co-inyectaban con exosomas de cÃĐlulas de cÃĄncer en ratones, se formaban los tumores (fig. 1) - a menos que se bloqueara la actividad de Dicer, lo que sugiere que esta es crÃtica para la transformaciÃģn de cÃĐlulas normales en cÃĐlulas tumorales en exposiciÃģn a exosomas.
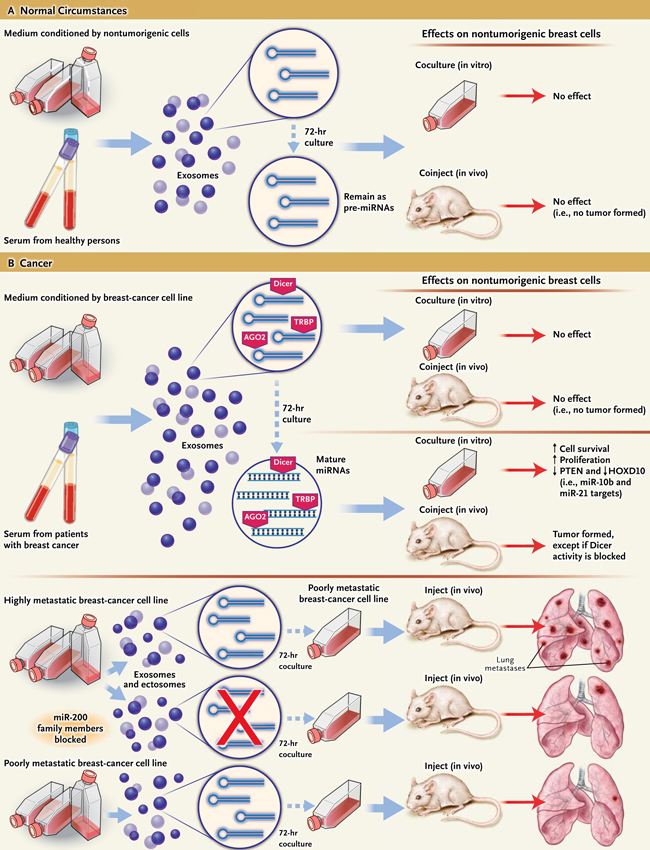
Figura 1: los exigentes pasos de los exosomas y ectosomas
Los exosomas son liberados en el medio circundante (medio acondicionado) por cÃĐlulas en cultivo y que tambiÃĐn se encuentran en muestras de suero. Se ha observado que estas estructuras en suero de personas sanas llevan microARN inmaduros precursores (pre- microARN), que permanecen como pre- microARN incluso cuando los exosomas son cultivados bajo condiciones de laboratorio durante 3 dÃas. Cuando tales exosomas se co-cultivaban con cÃĐlulas tumorigÃĐnicas o se co-inyectaban con estas cÃĐlulas en ratones, se daban efectos notables (panel A). Muestras de suero de pacientes con cÃĄncer contienen sustancialmente mÃĄs exosomas que las de controles sanos. Estos exosomas se enriquecen en pre-miARN, en comparaciÃģn con los de cÃĐlulas normales, y, poseen la maquinaria molecular que puede convertir los pre-miARN en miARN maduros.
Melo y colegas tambiÃĐn encontraron que las muestras de suero de pacientes con cÃĄncer tenÃan mÃĄs exosomas que las de controles sanos. TambiÃĐn observaron que seis pre-miARN idÃĐnticos, cuando se cultivan maduran a miARN en los exosomas de los pacientes, y no en los donantes sanos. Los exosomas de 5 de 11 de estos pacientes, cuando se inyectaron con celulas epiteliales de mama humanas no tumorales, inducÃan la formaciÃģn de tumores en ratones; los de 8 donantes sanos no.
La metÃĄstasis a Ãģrganos secundarios es la principal causa de muerte por cÃĄncer de mama y con frecuencia implica una transformaciÃģn de cÃĐlula epitelial a cÃĐlula mesenquimal y posterior reversiÃģn a epitelio, un proceso que estÃĄ regulado por la familia miR-200 de miARN. Otros autores han encontrado que los exosomas y vesÃculas mÃĄs grandes (denominadas ectosomas) pueden transferir miR-200 de cÃĐlulas altamente metastÃĄsicas a cÃĐlulas poco metastÃĄsicas y por lo tanto aumentar el potencial metastÃĄsico de las unidades poco metastÃĄsicas. Para empezar, utilizaron cÃĐlulas de cÃĄncer de mama de ratones triple negativo. Estas fueron expuestas durante 3 dÃas a cualquiera de sus vesÃculas extracelulares o a el derivado altamente metastÃĄsico, 4TE1. Cuando se inyectÃģ en la cola vena de los ratones, las cÃĐlulas que se pre-incubaron con las vesÃculas extracelulares a partir de cÃĐlulas altamente metastÃĄsicas formaban sustancialmente mÃĄs metÃĄstasis de pulmÃģn que las cÃĐlulas que se pre-incubadas con sus propias vesÃculas extracelulares. Este hallazgo se mantuvo, excepto cuando se bloquearon miembros de la familia miR-200, en cuyo caso habÃa menos metÃĄstasis pulmonar.
Parece que los exosomas en el contexto del microambiente estromal tambiÃĐn ejercen influencia en el comportamiento del tumor. Se ha encontrado que la exposiciÃģn a los exosomas del estroma crean una subpoblaciÃģn de cÃĐlulas de cÃĄncer de mama que son resistentes a la terapia y pueden iniciar la formaciÃģn del tumor. TambiÃĐn se ha observado que los inhibidores tisulares de las metaloproteinasas (TIMP) protegen contra la liberaciÃģn de exosomas tumorales de estroma: un agotamiento de TIMP resulta en cÃĐlulas similares a fibroblastos asociados al cÃĄncer. Los carcinomas de cÃĐlulas escamosas de cabeza y cuello son fuente de fibroblastos que disminuyen las TIMP; los exosomas derivados de tales fibroblastos incrementan la motilidad de las cÃĐlulas de cÃĄncer de mama.
Aunque todavÃa queda mucho por aprender acerca de los exosomas y ectosomas, estos estudios mejoran nuestra comprensiÃģn de las vesÃculas extracelulares, demostrando que llevan - y utilizan - la maquinaria necesaria para producir miARN maduros, que los exosomas derivados de cÃĐlulas cancerosas son cualitativamente diferentes de los derivados de cÃĐlulas no cancerosas, y que las vesÃculas extracelulares parecen capaces de mediar la transferencia de molÃĐculas que influyen en el potencial metastÃĄsico. Los exosomas estromales tambiÃĐn parecen influenciar de forma importante la biologÃa de las cÃĐlulas del cÃĄncer. Estudios adicionales estÃĄn garantizados para determinar las influencias de los exosomas y ectosomas sobre el cÃĄncer.
Fuente bibliográfica
Expanding on Exosomes and Ectosomes in Cancer
Lorraine OâDriscoll, Ph.D.
School of Pharmacy and Pharmaceutical Sciences and Trinity Biomedical Sciences Institute, Trinity College Dublin, Dublin.
DOI: 10.1056/NEJMcibr1503100