Un método antitumoral con adversidad
Los medicamentos utilizados como quimioterapia causan un daño en el ADN que desencadena la muerte de células cancerígenas de rápida división, y constituyen el tratamiento estándar para muchos tipos de cáncer. Sin embargo, debido a que también afectan células normales en división, la quimioterapia puede causar daño indeseable que resulta en efectos secundarios a corto plazo como náuseas y la caída del cabello. El daño en el ADN a partir de la quimioterapia también corre el riesgo de aumentar el número de mutaciones que podrían, a más largo plazo, dar lugar a otros tipos de cáncer o permitir que el tumor original desarrolle resistencia al tratamiento. Por este motivo el uso de terapias específicamente dirigidas a sus blancos celulares surgen como una opción terapéutica relevante para evitar estas complicaciones. Sin embargo recientes estudios muestran que éstas tampoco están libres de eventos secundarios ya que también inducirían daños inesperados en el genoma.
Daño al ADN y tumores
Las terapias dirigidas están diseñadas para bloquear las vías moleculares específicas en células cancerosas e inducir la muerte de células tumorales sin causar daños en el ADN. En una reciente investigación Compagno y colaboradores (Nature. 2017 Feb 23;542(7642):489-493) presentaron estudios realizados en modelos de ratón y células humanas que muestran que dos fármacos que se utilizan comúnmente en lugar de la quimioterapia en el tratamiento de ciertos cánceres de la sangre, inesperadamente aumentan el daño al ADN, tanto en células saludables como tumorales.
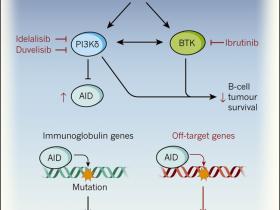
Los fármacos específicos en cuestión son ibrutinib e idelalisib. Estos dos compuestos son los primeros ejemplos de una clase emergente de terapias dirigidas que han revolucionado el tratamiento de ciertos tumores surgidos desde células inmunitarias conocidas como células B, y ambos compuestos han sido aprobados por la FDA. Los fármacos, a menudo se describen como inhibidores del receptor de células B, capaces de bloquear la acción de enzimas que transmiten las señales de las proteínas receptoras de estos linfocitos (figura 1). Estos receptores sostienen la supervivencia y mantienen las células tumorales en sitios anatómicos que proporcionan un ambiente nutricional propicio. Este mecanismo contribuye a explicar la eficacia de ambos agentes terapéuticos y su relativamente inocuo perfil de efectos secundarios.
Los ensayos clínicos de ibrutinib y de idelalisibun revelaron tasas sin precedentes de regresión tumoral leucémica, específicamente en la leucemia más común en adultos (leucemia linfocítica crónica LLC), incluidos aquellos grupos de alto riesgo que no responden a otras clases de terapia. Ibrutinib también ha sido aprobado para el tratamientode de otros tipos de cáncer, como el linfoma de células de manto y la macroglobulinemia de Waldenström. Aunque no todos los pacientes responden o toleran esos fármacos, la elevada tasa de respuesta y la aparición de otras terapias dirigidas condujeron a una disminución del uso de quimioterapias convencionales, en particular para la LLC.
Ibrutinib y idelalisib no dañan directamente al ADN ni interfieren con las enzimas encargadas de su reparación. Sin embargo, idelalisib se une a una enzima de señalización llamada PI3Kδ que suprime la expresión de la enzima AID, que tiene una capacidad potencialmente peligrosa de alterar la integridad del ADN. AID normalmente convierte las bases de citosina en uracilo en la secuencia de ADN de los genes de inmunoglobulinas, dando lugar a mutaciones y recombinación que son esenciales para la producción de diversos anticuerpos cuando se lucha contra una infección.
AID se expresa solo en las células B activadas en las que está ocurriendo una respuesta inmunitaria, y la acción enzimática está estrechamente controlada para dirigirse preferentemente a genes de inmunoglobulinas porque los cambios en otras secuencias de ADN pueden causar cáncer. Los efectos raros "fuera de objetivo" de la enzima AID en genes que no son de las inmunoglobulinas pueden contribuir al desarrollo de ciertos tumores de células B.
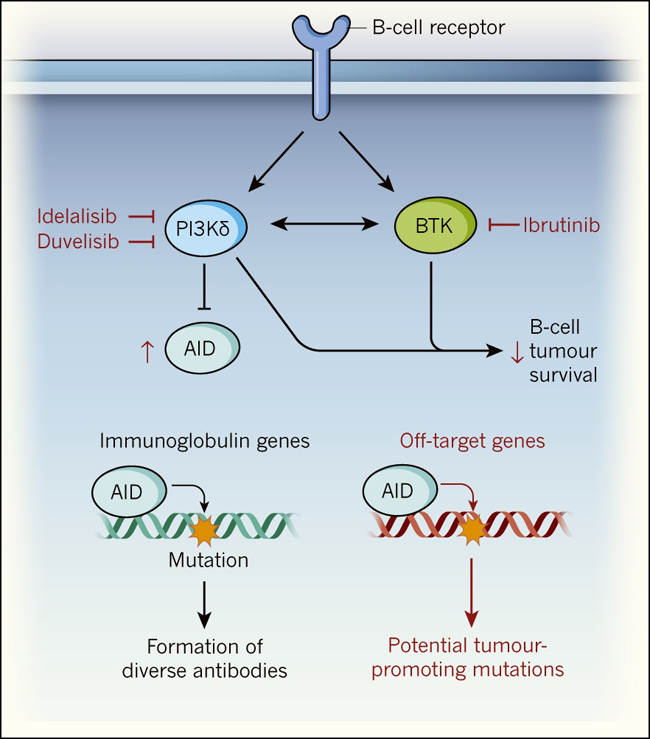
Figura 1: la inhibición de una vía de señalización del receptor de células B podría aumentar el número de mutaciones perjudiciales.
Algunos tipos de cáncer de sangre, como la leucemia linfocítica crónica, requieren la activación de una vía de señalización dependiente del receptor de células B para sobrevivir. En una vía de señalización río abajo del receptor de células B, las enzimas quinasas PI3Kδ y BTK han sido propuestas como dos promotoras de la actividad entre ellas mismas. Cuando una respuesta inmune occure, PI3Kδ mantiene baja la expresión de la enzima AID, lo que favorece la modificación del ADN en genes de inmunoglobulinas, facilitando la formación de diversos anticuerpos. Los fármacos idelalisib y ibrutinib se dirigen a una vía de señalización dependiente del receptor de células B y son utilizadas para el tratamiento del cáncer. Ambos inhiben PI3Kδ, y ibrutinib Inhibe BTK. Mediante el uso de modelos animales (ratón) y de células humanas, Compagno y sus colegas observaron que la inhibición de la vía de señalización del receptor de células B mediada por estos fármacos, puede aumentar la expresión de AID, causando mutaciones en el ADN en genes no propios de las inmunoglobulinas (en genes fuera de objetivo) elevando potencialmente la incidencia de mutaciones promotoras de tumores. Los efectos del consumo de fármacos son mostrados en rojo.
Compagno y sus colegas observaron que idelalisib o el inhibidor de PI3Kδ, duvelisib (un fármaco en investigación) aumentan la expresión de AID en linocitos B activos. Como era de esperar, este incremento fue acompañado por una mayor frecuencia de mutaciones en el blanco y eventos de recombinación en genes de inmunoglobulina. Este resultado podría alterar las respuestas de anticuerpos, pero probablemente no afectan a la salud de los pacientes. Sin embargo, fue de mayor preocupación el incremento de recombinaciones de ADN en lugares que no son los originales, llevando a algunos cambios en el ADN a menudo encontrados en células B tumorales. El tratamiento con Idelalisib y duvelisib aumenta la inestabilidad genómica en el linfoma de células del manto humanas. Usando células B de ratones deficientes en AID y células humanas que carecen de la misma enzima, los autores mostraron que el daño en el ADN desencadenado por inhibidores PI3Kδ depende de AID.
Ibrutinib inhibe una enzima conocida como BTK. En la mayoría de las vías de señalización dependientes del receptor de células B, BTK actúa río abajo de PI3Kδ y se piensa que no está involucrada en la vía que regula la expresión de AID. Sin embargo, algunos estudios sugieren que PI3Kδ y BTK trabajan juntas en un gran complejo de múltiples proteínas y apoyan la actividad de cada una. Compagno y sus colegas observaron que la inhibición de BTK con ibrutinib reduce la actividad PI3Kδ (monitorizado por la fosforilaciónde la proteína AKT) y aumenta la expresión de AID en las células B. En comparación al tratamiento con inhibidores de PI3Kδ, ibrutinib también dio como resultado aumentos en la mutación del ADN y eventos de recombinación, aunque en menor medida.
Dos experimentos clave apoyan la relevancia in vivo de estos hallazgos. En primer lugar, Compagno y sus colegas reportaron que idelalisib, duvelisib e ibrutinib incrementan el desarrollo de tumores de células B dependientes de AID en un modelo de ratón. En segundo lugar, el análisis de los autores del ADN de células de la sangre de personas con LLC antes y después del tratamiento con idelalisib demostró un aumento significativo de mutaciones fuera de blanco mediadas por AID.
Como señalan los autores, el seguimiento a largo plazo de los pacientes tratados con inhibidores de receptor de células B necesitará ser evaluado respecto al aumento de tumores dependientes de AID. Tanto ibrutinib como idelalisib fueron aprobados por la FDA hace menos de 5 años atrás. Estos agentes se dan indefinidamente, y el tratamiento se continúa generalmente hasta que la enfermedad se vuelva resistente o hasta que el paciente sufra un nivel inaceptable de toxicidad. En el ensayo clínico de fase II de ibrutinib, un grupo recibió el fármaco después del fracaso de la quimioterapia y la otra cohorte recibió este tratamiento convencional como su terapia inicial. En los cinco años de seguimiento de este ensayo, alrededor de un tercio de las personas que reciben ibrutinibfracaso tras fracaso de la quimioterapia estaba todavía en tratamiento con ibrutinib, mientras que dos tercios de las personas que recibieron ibrutinib como su tratamiento inicial todavía respondían a esta terapia y mantenían el medicamento.
Debido a que las remisiones completas con inhibidores del receptor de células B son poco frecuentes, hay poco entusiasmo por interrumpir la terapia - la presunción es que si el tratamiento fuera a cesar, la enfermedad se repetiría. Las estrategias recientes han explorado enfoques combinados de moléculas pequeñas como el uso de dos inhibidores de receptor de células B, en un intento de aumentar las tasas de remisión completa y permitir la interrupción de la terapia. Teniendo en cuenta que Compagno y sus colegas demuestran que fármacos previamente considerados no dañinos para el ADN, podrían ser perjudiciales al inducir inestabilidad genómica, la posibilidad de suspender la terapia podría convertirse en un concepto atractivo en ensayos clínicos a futuro.
Fuente bibliográfica
Cancer: A targeted treatment with off-target risks
David A. Fruman & Susan O’Brien
Department of Molecular Biology and Biochemistry, University of California, Irvine.
doi:10.1038/nature21504
Temas Relacionados