Nuevos enfoques para los trastornos mendelianos
Los continuos esfuerzos para desarrollar terapias para las enfermedades mendelianas representan una obligación y una oportunidad. Lo primero se refiere al hecho que aunque éstas son individualmente raras, suelen ser bastante comunes cuando se ven como grupo, y su carga sobre los pacientes pasa a ser considerable. Además, en gran parte, los individuos con trastornos genéticos poco comunes han impulsado el progreso en el campo de la genética humana y de las terapias moleculares a través de su entusiasta participación en las investigaciones. La oportunidad se refiere a la misma naturaleza de las condiciones; la participación causal de un solo gen y el defecto subyacente implica genes y vías que son suficientes para generar fenotipos de interés a ser considerados como propósito de ganancia terapéutica, incluso cuando se da en aquellos con una presentación más común y orígenes más complejos.
La identificación de los loci de susceptibilidad genética, por medio de estudios de asociación genómica, ha proporcionado interesantes pistas sobre la patogenia de estos trastornos mendelianos y sus futuras terapias y, sin duda, seguirá haciéndolo. La realización de este tipo de manejo se verá facilitado, en parte, mediante el uso de los conocimientos adquiridos en la investigación de enfermedades mendelianas para ordenar y priorizar las posibles soluciones que se obtendrán a partir de ensayos de asociación genómica.
Corrección de mutaciones al reparar el ARN
Imagínese un paciente joven con una enfermedad debilitante, quizás letal, La condición hereditaria al aparecer tiene un tratamiento regular. Se le inyecta un vector viral que proporciona una nano máquina personalizada a los tejidos afectados, reparando un error específico en su estructura de fabricación de proteínas (parte de la cual es ARN mensajero [ARNm]), y curar efectivamente la patología. Se transforma en un paciente sano y capaz de practicar deportes. ¿Ciencia ficción? Sí, lo es. Sin embargo, un reciente estudio de María Fernanda Montiel-González y colegas (Proc Natl Acad Sci U S A 2013; 110:18285-90) representa un paso hacia su realidad. Ellos detallan una nano máquina con ARN de reparación dentro de los límites de la tecnología actual.
Los enfoques terapéuticos para los trastornos mendelianos utilizan tácticas de reemplazo de genes por pequeñas moléculas diseñadas para corregir defectos funcionales, específicamente drogas que fuerza la síntesis completa de proteínas que de otro modo se truncaría en oligonucleótidos que alteran el empalme del ARN. La máquina de reparación descrita por el equipo de Montiel-González es diferente. Depende de una contradicción bizantina de la biología molecular (que establece que el ADN genera ARN, que a su vez produce la proteína). Esta contradicción es un proceso llamado edición de ARN adenosina a inosina (A→I). Aquí, las enzimas llamadas ADAR (desaminasa de adenosina que actúan sobre ARN) modifican químicamente los residuos de adenosina en residuos de inosina durante las transcripciones de ARN. Debido a que las maquinarias celulares "ven" el residuo de inosina como un residuo de guanosina (G, una de las cuatro bases del ARN), el efecto final es la conversión-mutación, si se quiere, de la adenosina a guanosina (A→G). En la naturaleza, los ARNm que codifican las proteínas son reelaborados por las ADAR para que incorporen cambios A→G. Más de la mitad de los aminoácidos del código genético se pueden modificar de esta manera. Curiosamente, la recodificación de una edición A→I parece ocurrir casi exclusivamente en el sistema nervioso animal. Las ADAR requieren que los residuos de adenosina de destino se alojen en una región de ARN de doble cadena (ARNdc) (fig. 1A), que se forma por lo general entre una secuencia de codificación (secuencia de ARN que codifica la proteína) y una secuencia no codificadora.
Los autores postulan que las consecuencias perjudiciales de cualquier mutación causada por la sustitución de un nucleótido de guanosina por un nucleótido de adenosina (G→A) podría invertirse a nivel de ARN por una ADAR dirigida apropiadamente. Pero, ¿cómo una ADAR podría revertir una adenosina mutante específica del paciente en un ARNm particular en forma de doble cadena?
La presente investigación utilizó un oligonucleótido de ARN con homología a la región del ARNm de interés, generando así una región de ARN dúplex (fig. 1B). A continuación, dirigieron la actividad enzimática de una ADAR a esta región y evitaron los efectos fuera de objetivo (no específicos) de la expresión ADAR en otros ARNdc expresados en una célula. Los autores resolvieron este problema mediante la sustitución de los dominios de unión del ARNdc de ADAR2 humano, lo que genéricamente uniría cualquier ARNdc, mediante una proteína específica del virus llambda N (λN). Normalmente, λN se une exclusivamente a una pequeña secuencia de ARN viral llamada boxB. Se encontró que la proteína quimérica, λN-ADAR, se unía a sitios boxB cuando se colocaba cerca de una región de ARN de doble cadena y era capaz de convertir A→I en la región ARNdc.
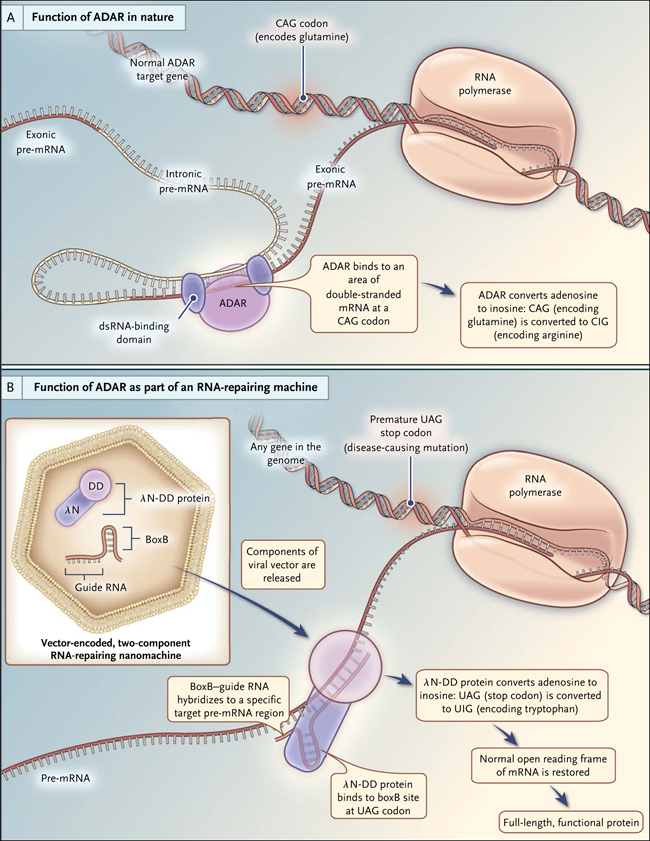
Figura 1: la ADAR en la naturaleza y como parte de una maquinaria de reparación del ARN
En el panel A, la ADAR (desaminasa de adenosina que actúa sobre el ARN) se representa como la unión a un ARN mensajero recién sintetizado (ARNm) que codifica una proteína en una región del ARN bicatenario (ARNdc) formado por pares de bases entre secuencias de codificación exónicas y secuencias no codificantes intrónicas. Normalmente, las ADAR se unen al ARN a través de sus dominios de unión. Aquí, un codón de glutamina se recodifica a un codón de arginina por la conversión a inosina. Como se muestra en el panel B, la enzima lambda N-ADAR (λN-DD) y el ARN boxB se codifican como parte de un sistema de entrega del vector viral (hexágono). Una vez expresados, estos componentes se ensamblan en una máquina de ARN-reparación altamente específica y dirigida a, en este caso, un codón de terminación prematuro (UAG = parada) que es una mutación causante de la enfermedad. La reparación de UAG a UIG resultada en una lectura a través del ribosoma: UIG es "interpretado" como un codón triptófano (UGG = W), para sintetizar la proteína con su longitud completa.
Los investigadores pusieron a prueba el enfoque en una mutación que causa fibrosis quística, la mutación W496X en CFTR. W representa el aminoácido triptófano, codificado en ARN por el triplete UGG, y X representa un codón de parada, codificado en ARN por el triplete de UAG. Por lo tanto, ellos trataron de modificar UAG en UIG, que luego se interpreta como UGG (que codifica triptófano), proceso que elude el codón de parada y permite la transmisión continua del ARNm CFTR y así producir la proteína CFTR normal. En esta etapa, los autores encontraron que podían "afinar" la longitud y la secuencia del oligonucleótido guía para modificar precisamente una, y sólo una, adenosina, para su reparación. Se fijó la secuencia boxB directamente al nucleótido de ARN (fig. 1B). En la inyección de la ADAR modificada y su introducción en oocitos de rana, el equipo de Montiel-González reparó eficientemente la mutación truncanda W496X CFTR así como la producción de una proteína de longitud completa. Aún más interesante, observaron que las funciones de la proteína CFTR "corregida" eran como en las células humanas: un canal de cloruro dependiente de ATP. También determinaron que este método corregía las mutaciones en un gen no humano en una línea celular de riñón embrionario humano.
No existe ninguna razón para creer que este sistema no funcionaría bien en un organismo eucariota. Las herramientas son simples, y el enfoque es particularmente eficaz para las mutaciones truncadas prematuramente, porque los tres codones de terminación (UAG, UAA y UGA) se pueden recodificar por la actividad ADAR en los codones UGG. Además, cualquier mutación G→A, incluyendo muchas alteraciones sin sentido de aminoácidos y mutaciones de corte y empalme, podrían ser reparadas mediante tal enfoque. Aunque los autores no obtuvieron la eficiencia perfecta en la corrección del ARNm mutante, una restauración parcial de la función puede ser terapéuticamente eficaz en muchos trastornos (por ejemplo, en la fibrosis quística). Sin embargo, los desafíos en la entrega de moléculas como las ADAR a células afectadas, en un organismo multicelular y complejo, son formidables, y dada la fugacidad del ARNm, las moléculas "terapéuticas" tendrían que establecer algún grado de permanencia en la célula para tener efecto duradero. Son estos los retos que hay que superar, una clase diferente de enzimas, que realiza la edición de ARN C→U, lo que potencialmente podría aprovecharse en una estrategia similar a la utilizada por el grupo de Montiel-González. Tal vez se podría diseñar un conjunto de herramientas tipo nano máquinas de ribonucleoproteínas y entregar los ARN reparados a medida para paciente.
Fuente bibliográfica
Correcting Mutations by RNA Repair
Robert Reenan, Ph.D.
Brown University, Providence, RI.
DOI: 10.1056/NEJMcibr1313514