Luchando contra la atrofia muscular espinal
La atrofia muscular espinal (AME) resulta de la ausencia o mutación del gen SMN1. Los genes SMN1 y SMN2 normalmente producen la denominada proteína de supervivencia de las neuronas motoras. Esta proteína es utilizada por el cerebro con el fin de controlar voluntariamente los músculos. Sin ésta, la médula espinal es incapaz de comunicarse con los músculos, debilitándolos por falta de uso y, finalmente, su atrofia. Los efectos patológicos generan una mayor debilidad e impiden que los afectados puedan moverse fácilmente. Con el tiempo, la condición pone en peligro la capacidad de respirar, lo que puede llevar a la muerte. La esperanza de vida de estos pacientes depende de la forma en que la enfermedad afecte a los músculos respiratorios. Al principio suele ser más problemática, pero la gravedad es el principal factor que determina el tiempo de vida de los afectados.
Un posible tratamiento para la atrofia muscular espinal
Cada científico, médico y paciente busca que algún santo grial cure una enfermedad. Esto se da fuertemente en el campo de la neurodegeneración. En las condiciones neurogenéticas, en la gran mayoría de los casos, el código aberrante está incrustado en el ADN celular, y la barrera sangre-cerebro es un obstáculo para la administración de fármacos. Por lo tanto, los tratamientos deben incluir regulares inyecciones intratecales o utilizar un mecanismo de entrega alternativo. Para la atrofia muscular espinal, uno de los trastornos neuronales más comunes y devastadores, el avance con nuevos candidatos terapéuticos en ensayos clínicos, incluyendo la terapia basada en oligonucleótidos antisentido y, más recientemente, la terapia génica con vectores basados en adenovirus, ha proporcionado esperanza y optimismo en el campo de la neurodegeneración. Sin embargo, este entusiasmo se ha enlentecido por la creciente toma de conciencia de que se requerirán enfoques sinérgicos para asegurar suficientemente la corrección del empalme del ARNm del gen que ayuda a la supervivencia de las neuronas motoras 2 (SMN2), especialmente para la forma infantil de la enfermedad, la más común y severa, la atrofia muscular espinal tipo 1. Un reciente trabajo de Nikolai A. Narishkin y colegas (Science 2014; 345:688-693) posibilita que una pequeña terapia molecularmente proporcione una tratamiento eficaz y disponible por vía oral para la atrofia muscular espinal. Estos investigadores utilizaron métodos para detectar e identificar pequeñas moléculas que se dirigen al corte y empalme del ARN con una alta eficacia y, más importante, elevada especificidad.
Los patrones de empalme del ARN a nivel de biología celular son más básicos. El ARN transcrito a partir de una plantilla génica se procesa para eliminar las secuencias no codificantes (intrones) antes de convertirse en un ARN mensajero maduro (ARNm) capaz de dirigir la síntesis de proteínas. Este proceso requiere una compleja maquinaria celular conocida como espliceosoma.
Un proceso conocido como corte y empalme alternativo del ARNm puede dar lugar a docenas de diferentes especies de ARNm a partir de una única plantilla pre-ARNm. Los resultados alternativos en la exclusión de uno o más exones de ARNm maduro, facilitan la expresión de diferentes isoformas proteicas (todos derivados del mismo gen) en diferentes etapas del desarrollo, en diferentes tejidos, y en respuesta a señales ambientales, tales como el estrés o lesión celular. La identificación de moléculas pequeñas que modifiquen el empalme y, a su vez, alteren la cantidad o calidad de las transcripciones de un determinado ARNm que contribuye a la patogénesis de la enfermedad, proporciona una vía atractiva para el desarrollo de terapias focalizadas. La naturaleza dinámica del transcriptoma (conjunto de moléculas de ARN en una célula) permite un rápido efecto sobre un objetivo seleccionado, y las líneas celulares de los pacientes pueden identificar los posibles efectos no deseados antes de poder avanzar a la fase 1 de los estudios.
La atrofia muscular espinal ha sido durante mucho tiempo un objetivo atractivo para el empalme terapéutico. La condición es causada por la interrupción homocigota del gen SMN1; ambas copias de SMN1 en una persona deben ser interrumpidas para que se produzca la enfermedad. Sin embargo, los seres humanos tienen dos genes parálogos SMN. El otro, el SMN2, es muy similar a SMN1, con algunas diferencias en las secuencias. Uno de estas se encuentra en la posición del nucleótido 840; el residuo de timidina en SMN2 activa un empalme alternativo y excluye el exón 7 de la mayoría de las transcripciones SMN2 generadas y, a su vez, resulta en la generación de una proteína SMN truncada que se degrada rápidamente (figura 1).
La proteína SMN desempeña un papel integral en el ensamblaje del espliceosoma y el procesamiento de especies pre-ARNm en todas las células. Las investigaciones también la han implicado en procesos de transcripción, en la respuesta al estrés celular, apoptosis, la dinámica del citoesqueleto y el transporte axonal.
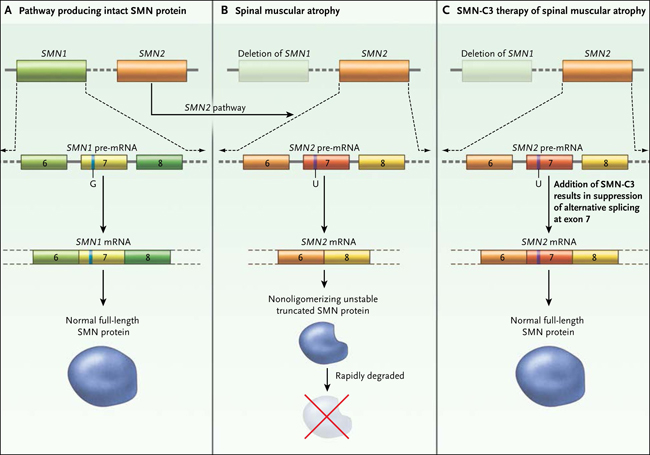
Figura 1: alternativa de empalme del ARN mensajero (ARNm) SMN2 como un objetivo para las terapias con pequeñas moléculas.
SMN1 y SMN2 son genes parálogos que codifican la proteína para la supervivencia de las neuronas motoras (SMN) (panel A). SMN2 difiere de SMN1 por tener una T (U en el pre-ARNm) en lugar de una C (G en el pre-ARNm) en el nucleótido 840, creando un sitio de corte y empalme alternativo en el ARNm de SMN2 que se traduce en la exclusión del exón 7 en la mayoría de las transcripciones. Esto se traduce en una proteína inestable, que se degrada rápidamente. En la enfermedad, SMN1 produce poco o nada de transcripción, y por lo tanto prácticamente ninguna proteína SMN de longitud completa (panel B). La adición de SMN-C3, una pequeña molécula que modifica el empalme de SMN2, es capaz de generar altos niveles de SMN de longitud completa (panel C).
Dado que todos los pacientes con atrofia muscular espinal tienen al menos una copia intacta de SMN2, sólo una molécula pequeña podría suprimir el empalme alternativo del ARNm SMN2, y así "rescatar" el ARNm de longitud completa y aumentar los niveles de proteína SMN, tendría un amplio potencial terapéutico. Por desgracia, la promesa inicial de los inhibidores de la histona deacetilasa (por ejemplo, ácido valproico) obtenidos de cultivos celulares de pacientes y animales con atrofia muscular espinal no se ha podido realizar. Además, los efectos tóxicos presentan un gran obstáculo para estas y muchas otras prometedoras terapias con moléculas pequeñas.
Narishkin y colegas utilizaron una línea de células de riñón embrionario humano con un minigen SMN2 (fragmento de gen que contiene regiones reguladoras y codificadoras de SMN2 que son suficientes para retener las funciones del gen no mutado) para seleccionar una biblioteca de moléculas pequeñas que promueven la inclusión del exón 7 de zonas transcriptoras de ARNm de SMN2. Ellos identificaron tres compuestos disponibles por vía oral que llamaron SMN-C1, SMN-C2 y SMN-C3. Además, encontraron que los tres modificaban el empalme SMN2 y aumentaban la biosíntesis de proteínas de SMN en fibroblastos de pacientes con atrofia muscular espinal tipo 1, tipo 2, tipo 3 y en los controles (personas asintomáticas con una sola deleción SMN1) de una manera dosis dependiente. También observaron un efecto similar en neuronas motoras cultivadas, así como en células madre pluripotentes inducidas. Finalmente, se caracterizó la selectividad de estos compuestos mediante el análisis de secuencia de ARN para comparar las células tratadas con las controles. Se identificaron sólo 6 genes (de un total de 11.714) en el que la transcripción era regulada positiva o negativamente por un factor de 2, sugiriendo un alto nivel de especificidad. Lo más importante, es haber obtenido un beneficio sustancial de estos compuestos en dos modelos animales diferentes de atrofia muscular espinal, a través de una variedad de resultados relevantes, incluyendo mejoras en la supervivencia y de la función motora, y la preservación del circuito motor.
El tiempo dirá si la aparente promesa de estos compuestos u otros relacionados se podrán aplicar en pacientes con atrofia muscular espinal en la misma medida como se ha demostrado en cultivos celulares y modelos animales. Los datos emergentes señalan que un transcriptoma radicalmente alterado precede a la degeneración y pérdida de las neuronas motoras, por lo tanto, revertir los efectos en pacientes sintomáticos, sin duda, va a representar un considerable desafío terapéutico. La información obtenida en este y otros estudios realzan la necesidad de intervenciones terapéuticas tempranas, incluso presintomáticas, Sin embargo, las terapias con moléculas pequeñas siguen siendo potenciales herramientas para modificar el transcriptoma de una manera discreta y específica, y al hacerlo, mejorar algunas enfermedades.
Fuente bibliográfica
Romancing the Spliceosome to Fight Spinal Muscular Atrophy
Kathryn J. Swoboda, M.D.
Department of Neurology, University of Utah School of Medicine, Salt Lake City.
DOI: 10.1056/NEJMcibr1409795