¿Inmunidad estimulada por lo dulce?
Una vía previamente desconocida que permite a las células de mamíferos identificar una infección y desencadenar una respuesta inmunitaria requiere la participación de una enzima del tipo quinasa en la célula huésped para unirse a moléculas de azúcar producidas por bacterias. Esta enzima puede convertir estos metabolitos bacterianos -que inducen una escasa activación inmunológica- en patrones moleculares asociados a patógenos con una alta capacidad de respuesta inmunitaria. Este tema es particularmente relevante para el tratamiento de patógenos que invaden el citoplasma, como es el caso del género Shigella -patógeno gram negativo que introduce sus PAMP (azúcares) directamente al citoplasma de la célula hospedadora. Este conocimiento también ofrece una nueva perspectiva sobre los tipos de moléculas que pueden actuar como PAMP y sobre sus receptores de reconocimiento, información crucial para la comprensión del sistema inmunológico innato y su actividad frente a este tipo de infección bacteriana.
Azúcares bacterianos
Las infecciones bacterianas son una de las principales causas de enfermedad y muerte en todo el mundo. La división innata del sistema inmunológico de los mamíferos, que reconoce y reacciona ante las características generales de los patógenos, tiene una función protectora clave. Recientemente un estudio de Ping Zhou y colaboradores de la Aacademia China de Ciencias, describe un mecanismo por el cual el sistema inmune innato se activa en respuesta a moléculas de azúcar bacterianas (DOI: 10.1038/s41586-018-0433-3) Este hallazgo amplía la comprensión de los tipos de moléculas que pueden reconocerse como sellos distintivos de la infección y de las proteínas del hospedero que pueden reconocer dichas moléculas.
Un avance clave en la comprensión de cómo funciona el sistema inmunológico innato fue la identificación de proteínas llamadas receptores de reconocimiento de patrones (PRR), que identifican moléculas "no propias" -patrones moleculares asociados a patógenos (PAMP)-. Comenzando con los receptores Toll y tipo Toll (TLR, del inglés Toll-like receptror) PRRs2 a finales de la década de 1990, la identificación de los PRR y de los PAMP que ellos reconocen, ha avanzado a un ritmo vertiginoso.
Una función clave de los PRR es ayudar a impulsar la expresión de proteínas secretadas llamadas citoquinas, que alertan al sistema inmunitario sobre la infección. El factor de transcripción NF-κB es un regulador central de la expresión de citoquinas. Zhou y sus colegas estudiaron células humanas cultivadas in vitro para tratar de identificar las vías que activan a NF-κB en respuesta a la infección por la bacteria Yersinia pseudotuberculosis. Esta bacteria tiene una estructura multiproteica similar a una aguja llamada sistema de secreción tipo III (T3SS), que se requiere para la transferencia directa de proteínas bacterianas a las células hospedadoras. El T3SS es conservado evolutivamente en muchas bacterias patógenas.
Zhou y sus colegas adoptaron un enfoque imparcial y examinaron una colección de mutantes genéticos de Y. pseudotuberculosis para identificar genes bacterianos vinculados con la activación de NF-κB en respuesta a la infección. Esto llevó a los autores a centrarse en la enzima HldE, que cataliza los pasos en la vía biosintética de lipopolisacárido (LPS). El LPS es un componente esencial de la superficie celular de un subconjunto de patógenos bacterianos (gram negativos).
Usando bacterias genéticamente modificadas y moléculas de azúcar purificadas, los autores buscaron localizar las moléculas en la vía biosintética del LPS que estimulan la activación de NF-κB. Encontraron que la presencia de azúcares bacterianos, incluyendo ADP-β-D-mano-heptosa (ADP-Hep) y D-glicero-β-D-mano-heptosa 1,7-bisfosfato (HBP), en el citoplasma de la célula anfitriona desencadena la activación de NF-κB. Esto es consistente con un estudio previo sobre la bacteria.
Neisseria meningitidis que demostró que la HBP puede desencadenar respuestas de NF-κB en las células (DOI: 10.1126/science.aaa4921). Crucialmente, Zhou y sus colegas demostraron que el ADP-Hep es 100 veces más potente que el HBP en la activación de NF-κB. También evidenciaron que la adición de ADP-Hep al ambiente extracelular puede activar el factor transcripcional, sugiriendo que proteínas transportadoras de la célula hospedera ingresan la ADP-Hep al citoplasma.
No se conoce ningún PRR que reconozca ADP-Hep. Para buscar uno, los autores utilizaron edición genética para generar mutaciones aleatorias en las células huéspedes y probar si las mutaciones afectaban el reconocimiento de ADP-Hep. Descubrieron dos genes candidatos que codifican respectivamente la enzima quinasa ALPK1 y la proteína TIFA. También demostraron que estos son necesarios para la activación de NF-κB en respuesta a ADP-Hep en las células (figura 1). Un estudio anterior ha revelado que TIFA es necesaria para el reconocimiento de la HBP de N. meningitidis. La señalización ALPK1 y TIFA también se ha relacionado con la activación dependiente de HBP de NF-κB en respuesta a la infección por las bacterias Shigella flexneri y Helicobacter pylori. Usando enfoques bioquímicos, Zhou y sus colegas demostraron que ADP-Hep se une directamente al terminal amino de ALPK1. Los autores resolvieron la estructura cristalina de rayos X de ALPK1 en un complejo con ADP-Hep, y validaron su modelo estructural probando el efecto de las mutaciones en ALPK1 que perjudicarían su unión a ADP-Hep.
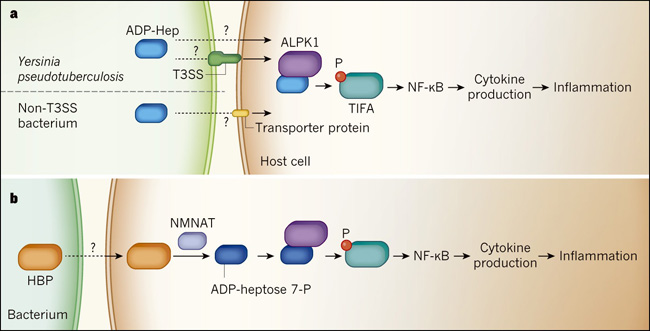
Figura 1. Los azúcares bacterianos desencadenan una respuesta inmunitaria del huésped.
a, Zhou y colaboradores demuestran que en bacterias como Yersinia pseudotuberculosis -que poseen un complejo multiproteico llamado sistema de secreción tipo III (T3SS), y en otras especies bacterianas que carecen de T3SS- que la molécula de azúcar ADP-β-D-mano-heptosa (ADP-Hep) puede entrar en una célula hospedadora por una vía desconocida (posiblemente a través de una proteína transportadora), y puede desencadenar una vía de señalización que impulsa la inflamación. Cuando ADP-Hep entra en la célula, se une a ALPK1, que activa la proteína TIFA añadiéndole un grupo de fosfato (P). La vía de señalización río abajo (no se muestran todos los pasos) conduce a la activación de NF-κB, que impulsa la expresión citoquinas que favorecen una respuesta inmune frente a la infección. b, Los autores también reportaron que si el azúcar bacteriano D-glicero-β-D-mano-heptosa 1,7-bisfosfato (HBP) ingresa a la célula huésped (por una ruta aún por determinar), puede ser convertido por las enzimas de la familia NMNAT en la molécula ADP-heptosa 7-P. Esta se une a ALPK1 y activa la misma vía que la activada por ADP-Hep.
Zhou y sus colegas también generaron ratones con deficiencia de ALPK1. La producción de citoquinas dependiente de NF-κB se redujo significativamente en estos animales después del desafío con ADP-Hep o con la bacteria patógena Burkholderia cenocepacia, en comparación con los resultados observados en animales que no presentaban deficiencias en ALPK1. Además, el número de bacterias en los pulmones de ratones infectados con B. cenocepacia fue mayor en animales con deficiencia de ALPK1 que en ratones silvestres.
Quizás el hallazgo más sorprendente es que las enzimas adeniltransferasas de mamíferos, específicamente las de la familia NMNAT, catalizan una reacción que convierte la HBP en una molécula llamada ADP-heptosa 7-P, que puede actuar como un ligando al unirse a ALPK1. En trabajos anteriores se había sugerido que HBP es un PAMP que puede activar directamente NF-κB. Aunque la HBP puede definirse como un PAMP, dado que es una molécula derivada de una bacteria que desencadena una respuesta en el huésped, los datos de Zhou y colegas indican que la HBP debe convertirse a ADP-heptosa 7-P por las enzimas para desencadenar esta respuesta. Los autores informan de ligeras diferencias en la forma en que ADP-Hep y ADP-heptose 7-P se unen a ALPK1, y utilizan estas diferencias para demostrar por qué ADP-Hep y no HBP o ADP-heptose 7-P es el ligando relevante para la activación de NF-κB mediada por ALPK1, al menos en la infección por Y. pseudotuberculosis.
Los hallazgos tienen implicaciones importantes. La evidencia de que el ADP-Hep sea un PAMP aumenta la conciencia de que los metabolitos bacterianos pueden actuar como PAMP. Dado que el ADP-Hep es necesario para sintetizar un componente esencial de la membrana externa de la mayoría de las bacterias gram negativas, esto lo convierte en un PAMP ideal. Sin embargo, no se sabe cómo esta molécula, que normalmente se encuentra dentro de la bacteria, llega al citoplasma de la célula huésped. En la Y. pseudotuberculosis, este proceso requiere el T3SS, aunque no está claro si el ADP-Hep es transportado activamente o se filtra accidentalmente a través del T3SS, o si entra por los poros que el T3SS genera en la membrana de la célula huésped.
Los autores reportaron que las especies bacterianas que carecen de T3SS pueden desencadenar la vía ALPK1 de una manera dependiente de ADP-Hep, consistente con la capacidad de ADP-Hep purificado para activar la vía por una ruta extracelular. Esto sugiere que podría existir un sistema de transporte que permita a la célula huésped obtener muestras de su entorno extracelular para detectar la presencia de este PAMP, similar a la forma en que se transportan ciertos PAMP extracelulares al citoplasma para su reconocimiento por las proteínas celulares.
¿Por qué ocurre la exposición bacteriana al ADP-Hep si activa el sistema inmunológico innato? Tal vez su liberación sea necesaria para cumplir alguna función aún desconocida. Los patógenos a menudo desarrollan mecanismos para evadir o frustrar una respuesta del sistema inmunológico. Si los patógenos han creado estrategias para evitar desencadenar una respuesta inmunitaria mediada por ADP-Hep, la comprensión de tales estrategias podría sugerir nuevos enfoques terapéuticos para combatir las infecciones bacterianas.
Fuente bibliográfica
An immune response with a sweet tooth
John-Demian Sauer
Department of Medical Microbiology and Immunology, University of Wisconsin–Madison, Madison, Wisconsin 53706, USA.
DOI: 10.1038/d41586-018-05854-y