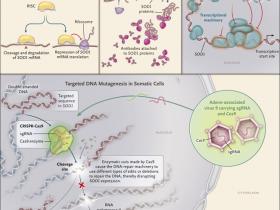
¿Edición genética para tratar ELA?
La esclerosis lateral amiotrófica (ELA) es una enfermedad neurodegenerativa fatal e incurable caracterizada por la pérdida progresiva de neuronas motoras en la médula espinal y el cerebro. En particular, las mutaciones autosómicas dominantes en el gen de la superóxido dismutasa 1 (SOD1) son responsables de ~20% de todos los casos familiares. El sistema de edición del genoma CRISPR-Cas9 tiene el potencial de tratar este trastorno al facilitar la introducción de mutaciones con desplazamiento del marco de lectura que pueden desactivar la función del gen mutante. Recientemente, se demostró que CRISPR-Cas9 puede interrumpir la expresión de SOD1 mutante en un modelo de ratón para el estudio de ELA. La edición genómica redujo la proteína SOD1 mutante en la médula espinal lumbar y torácica, lo que resultó en una mejora de la función motora y una disminución de la atrofia muscular. Este enfoque ilustra el potencial de esta revolucionaria técnica para tratar formas de ELA ligadas a SOD1 y otros trastornos del sistema nervioso central causados por mutaciones autosómicas dominantes.
Bloqueo de SOD1
Un desafío clave en la genética médica es suprimir la expresión de genes mutantes que causan enfermedades transmitidas como rasgos dominantes. Esto, particularmente para los trastornos neurodegenerativos. Muchos de estos problemas tienen una genética hereditaria dominante y no son reversibles con terapias convencionales. Un ejemplo es la esclerosis lateral amiotrófica (ELA): aproximadamente el 15% de los casos pueden atribuirse a variantes génicas dominantes, aunque probablemente quedan muchos genes responsables por descubrir.
Existen cuatro enfoques para suprimir los efectos tóxicos de los genes causales: 1. El uso de microARN u oligonucleótidos antisentido (ASO; secuencias de ADN o ARN complementarias diseñadas para emparejarse con la secuencia objetivo y activar la degradación del ARN) para la ablación del ARN transcrito a partir del gen. 2. La reducción de la carga de la proteína mutante (por ejemplo, reducción mediada por el sistema inmunológico). 3. La interferencia del proceso transcripcional mediante moléculas pequeña. 4. Mutagénesis de células somáticas - es decir, la retro-mutación del gen en las células germinales normales hacia su tipo silvestre (Fig. 1). Varios estudios han documentado que los tres primeros métodos son factibles. La gran ventaja de la última aproximación es que la corrección del ADN mutante elimina las anormalidades río abajo y es al menos en teoría, una intervención individual.
Sin embargo, la mutagénesis de células somáticas ha sido elusiva. Métodos que implican el uso de enzimas especializadas (por ejemplo, las nucleasas con dedos de cinc) dirigidas a regiones específicas del ADN, no han demostrado ser eficientes. Particularmente interesante, es el debut de los métodos basados en la edición genética CRISPR (clustered regularly interspaced short palindromic repeats) -Cas9. CRISPR-Cas9, que junto con un ARN de guía única (sgRNA), constituyen un complejo que se dirige a una secuencia génica determinada para la edición y corrección precisa de genes. El reto es llevar a cabo esta edición en condiciones in vivo.
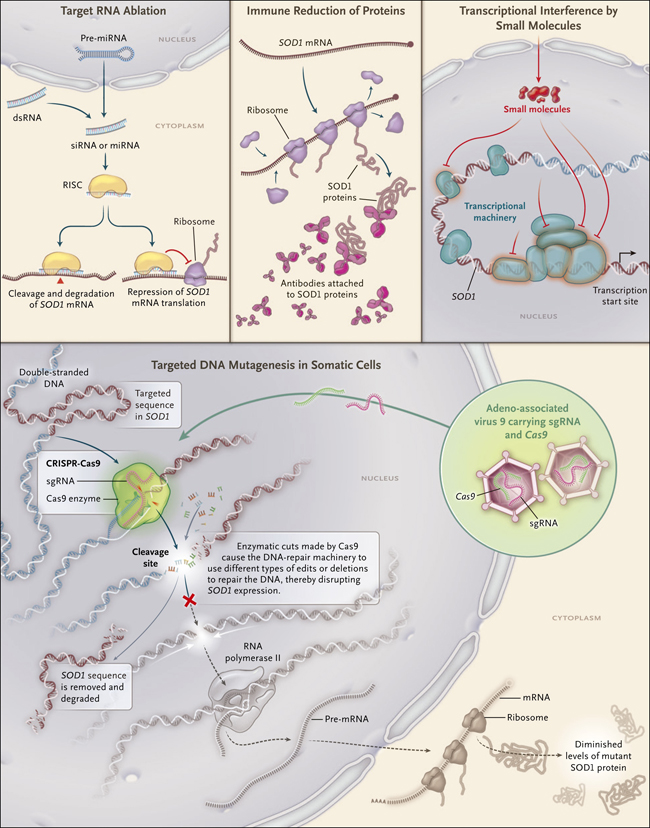
Figura 1. Cuatro maneras de suprimir la expresión de un gen.
Existen cuatro enfoques para suprimir los efectos tóxicos de un gen mutado: ablación de ARN, reducción inmunológica de la proteína, interferencia transcripcional con pequeñas moléculas, y mutagénesis del ADN. En la ablación del ARN, el pre-microARN (pre-miRNA) que puede ser endógeno o externo, o bien, ser de doble cadena (dsRNA) es escindido por la proteína Dicer en secuencias de 21 pares de bases (bp). Estas secuencias pueden ser incorporadas en el complejo silenciador inducido por ARN (RISC). RISC entonces se une a la secuencia de destino y la reprime. La degradación del ARN también puede lograrse mediante entregando una sola hebra de ADN modificado que se dirige al ARN mensajero (ARNm). Entonces, una ribonlucleasa (RNasa H) reconoce y degrada el ARN objetivo. La reducción inmunitaria depende de los anticuerpos que se dirigen hacia la proteína anómala. En la interferencia transcripcional con moléculas pequeñas, se utilizan medicamentos que bloquean los potenciadores o activadores de la transcripción para reducir o prevenir la formación de proteína. CRISPR-Cas9 muta el ADN mediante el corte en la doble hebra del ADN en una secuencia específica, a los que está dirigido por su ARN de guía (sgRNA). Después del corte, la maquinaria endógena de reparación de ADN de la célula automáticamente trata de arreglar la secuencia y es en este momento que los diferentes tipos de ediciones (por ejemplo, las eliminaciones) pueden ser introducidas en el sitio de escisión. Thomas Gaj y colegas (DOI: 10.1126/sciadv.aar3952) diseñaron un sistema CRISPR-Cas9 para interrumpir la expresión de la superóxido dismutasa 1 humana (SOD1) en un modelo de ratón transgénico de ELA.;Para esto, introdujeron el sistema CRISPR-Cas9 en un vector viral y lo inyectaron en las venas faciales de ratones afectados, después de lo cual disminuyeron los niveles de proteína mutante en las espinas lumbares y torácicas y se retrasó el comienzo de la enfermedad. La abreviatura siRNA denota ARN interferente pequeño.
En un estudio recientemente reportado por Thomas Gaj y colegas (DOI: 10.1126/sciadv.aar3952) se utilizó un virus adeno-asociado (AAV9) para entregar el sistema CRISPR-Cas9 a ratones transgénicos portadores de múltiples copias mutantes de superóxido dismutasa 1 de humanos (SOD1) (en el que la glicina se sustituye por alanina en la posición 93). La ELA se desarrolla en estos ratones aproximadamente en 90 días después del nacimiento, y los animales mueren aproximadamente a los 125 días. Dentro de un día después de que nacieran los ratones, los autores inyectaron a través de la vena facial, un AAV9 que contiene CRISPR-Cas9 y un sgRNA diseñado para dirigirse a SOD1, logrando una entrega sistémica. Respecto a roedores no tratados, detectaron una reducción de un 30% y 39% en los niveles de proteínas mutantes en la columna vertebral lumbar y torácica, respectivamente, y un retraso del 37% en inicio de la enfermedad (a partir de una media de 92 días después del nacimiento a una media de 126 días). Aunque la tasa de progresión de la enfermedad no se ralentizó, el retraso en su comienzo prolongó la sobrevivencia en un 25%. Una desventaja de este enfoque es que la actividad de CRISPR-Cas9 está en curso, lo que aumenta el riesgo de efectos fuera del objetivo, aunque estos fueron mínimos en el estudio.
Sin embargo, se encuentran varios obstáculos en el camino entre este estudio de prueba de principio en ratones y el tratamiento de humanos con ELA. Una consideración clave es el momento del tratamiento. Los autores entregaron el sistema de edición genética inmediatamente después del nacimiento, cuando la barrera hematoencefálica es más permeable, y antes de que la enfermedad esté totalmente activa. Aunque la detección en el útero para mutaciones en familias con ELA podría ser posible, esto excluiría el tratamiento para personas que tienen una causa genética pero que no tienen antecedentes familiares. Tales casos sólo son detectables a través del cribado a nivel poblacional.
Hay pruebas de que el enfoque de la CRISPR-Cas 9 es eficaz contra los cambios estructurales del genoma, como en las variaciones en el número de copias de un gen. De hecho, el modelo de ratón usado en el estudio alberga múltiples copias del transgen. Sin embargo, es difícil saber si el tratamiento sería eficaz para variaciones génicas comúnes que tienen un pequeño efecto sobre el riesgo o para el 1% de las personas con dos variantes raras subyacentes a su enfermedad. Un último punto es que la técnica también podría ser útil para desactivar variantes que acortan la supervivencia (en lugar de aumentar la susceptibilidad); tal estrategia podría ser efectiva en el tratamiento de personas después de la aparición de la enfermedad.
Fuente bibliográfica
Finding a Treatment for ALS — Will Gene Editing Cut It?
Ammar Al‑Chalabi, Ph.D, and Robert Brown, M.D.
Department of Neurology, University of Massachusetts Medical School, Worcester.
DOI: 10.1056/NEJMcibr1716741