Decodificando la metástasis cancerosa
La metástasis, el proceso que permite a algunas unidades cancerosas desprenderse de su tumor de origen y echar raíces en un tejido diferente, es la razón más común de muerte por cáncer en las personas. Por otra parte, los tumores cerebrales metastásicos son diez veces más comunes que los cánceres cerebrales primarios.
Sin embargo, la mayoría de las células tumorales mueren antes de llegar al cerebro, el que suele estar mejor protegido que la mayoría de los órganos contra la colonización por células tumorales circulantes. Para infiltrar el cerebro, una célula cancerígena debe desprenderse de su origen, entrar en el torrente sanguíneo y cruzar los vasos sanguíneos densamente empaquetados, lo que se llama barrera hematoencefálica. Hasta ahora, poco se ha investigado sobre cómo se desarrollan los tumores cerebrales metastásicos, pero los experimentos en modelos de ratón han demostrado que de las células cancerosas que llegan al cerebro, menos de una en 1.000 sobreviven.
Cáncer y vasculatura
La disponibilidad de oxígeno y de nutrientes suministrados por la vasculatura es crucial para el crecimiento tumoral y la metástasis. El estudio de la angiogénesis, la formación de nuevos vasos a partir de los preexistentes, ha proporcionado una gran cantidad de datos sobre cómo los tumores regulan este proceso y dado lugar a nuevos enfoques terapéuticos para el cáncer. Sin embargo, un creciente cuerpo de literatura ha puesto al descubierto una complejidad adicional: algunos tumores primarios y metastásicos pueden desarrollarse y progresar en ausencia de angiogénesis mediante la cooptación de la vasculatura preexistente. Las mejores descripciones de este tipo de crecimiento maligno se informaron inicialmente en estudios en pulmones y, posteriormente, en hígado y el cerebro.
La capacidad de identificar la cooptación vascular en el cáncer es relevante para el tratamiento, por dos razones. La primera es que la cooptación vascular puede causar resistencia a los fármacos antiangiogénicos; en consecuencia, su identificación ayudaría a distinguir los tumores que son más propensos a responder a los agentes antiangiogénicos. La segunda es que el conocimiento de las vías que determinan el crecimiento no angiogénico en las células cancerosas puede conducir a la identificación de nuevas moléculas para el tratamiento dirigido.
Manuel Valiente y colaboradores (Cell 2014; 156:1002-16) acaban de describir el desarrollo de metástasis en el cerebro, que son típicamente perivascular. A través de análisis de tumores humanos y de datos obtenidos a partir de modelos de ratones, los autores demostraron cómo las células metastásicas se resisten a la apoptosis y cooptan a los vasos del cerebro mediante la expresión de la proteína neuroserpina, que bloquea la generación de plasmina (fig. 1). La plasmina protege al cerebro de metástasis mediante la promoción apoptótica de las células cancerosas y la inhibición de su propagación a lo largo de la vasculatura - una reacción de defensa del tejido cerebral a las células malignas que entran en el parénquima. La vinculación de estos dos eventos (la entrada de células tumorales metastásicas y la producción de plasmina) es el astrocito. En respuesta a la inflamación, al daño del parénquima y el paso de las células metastásicas a través de la barrera del cerebro, los astrocitos expresan altos niveles de dos proteínas: el ligando dFas (FasL) y el activador de plasminógeno (PA). El aumento de los niveles de PA trasforma al plasminógeno (secretado por las neuronas) en su forma activa, plasmina, que puede entonces actuar sobre varias otras proteínas, incluyendo FasL y la molécula de adhesión L1CAM.
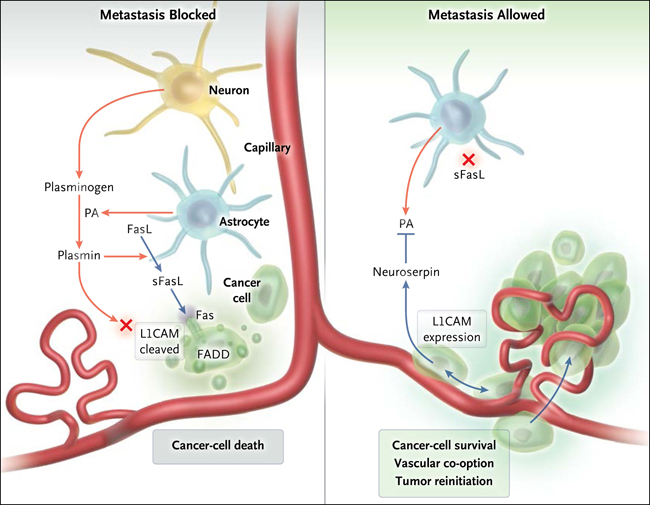
Figura 1: la célula tumoral y los astrocitos
A la izquierda se muestra un modelo para la actividad antimetastásica del sistema activador del plasminógeno (PA), donde la expresión de PA por los astrocitos lleva a la muerte de las células de cáncer y pérdida de adherencia. PA libera plasmina a partir de su proteína precursora, el plasminógeno. La plasmina activa la apoptosis mediante la generación de sLFas y escinde la molécula de adhesión L1CAM, perdiendo la capacidad de sobrevivir de las células cancerosas al adherirse y extenderse a lo largo de la vasculatura. A la derecha, la expresión de neuroserpina por los bloques del tumor invasor, lo que a su vez conduce a la supervivencia de las células cancerígenas y su adhesión a los vasos.
FasL se une a la membrana de los astrocitos, pero la plasmina es capaz de escindir y liberar su forma soluble, sLFas, que puede a su vez unirse a su receptor, Fas, en la célula tumoral y desencadenar la apoptosis. Sin embargo, en presencia de células cancerosas que expresan altos niveles de neuroserpina, inhibe la producción de astrocitos por parte de PA, bloqueando de este modo la liberación de plasmina a partir de plasminógeno y la supresión de la secreción de sLFas, provocando, por lo tanto, la apoptosis celular tumoral.
Una segunda consecuencia de la expresión de la neuroserpina, resultante de su freno en la generación de plasmina, es que la molécula L1CAM expresada por la célula tumoral no se escinde y es inactivada por la plasmina. L1CAM permanece intacta en la célula metastásica y conserva su función como una molécula de adhesión celular. Este rol es esencial para la coopción vascular, debido a la incapacidad de las células cancerosas a la co-opción de los vasos una vez que la expresión de L1CAM es inhibida. A la inversa, cuando aumenta la expresión de L1CAM, las células neoplásicas muestran una mayor adherencia a la superficie abluminal de los vasos.
El crecimiento no angiogénico de los tumores de pulmón e hígado parece ser bastante diferente al de las metástasis en el sistema nervioso; el mecanismo descrito por el grupo de M. Valiente es poco probable que sea importante para el crecimiento del tumor en pulmón y el hígado. Al respecto, el estudio sugiere que el tipo de vascularización asociada a un tumor refleja la biología de las células malignas por un lado y la estructura anatómica del órgano por otro.
Uno de los desafíos es mapear las rutas activas en los vasos intratumorales y distinguir aquellos vasos nuevamente formados través de la angiogénesis de vasos preexistentes que han sido cooptados por el tumor. También será fundamental identificar, dentro de estos dos grandes grupos, los biomarcadores vasculares que puedan orientar la elección del tratamiento. Hasta ahora, sólo unos pocos marcadores están disponibles para hacer frente a este problema (por ejemplo, los que indican la presencia de pericitos).
Al tomar en consideración la biología de las células neoplásicas y el tipo específico de vascularización con el que están asociados, podría preverse un enfoque de tratamiento en dos frentes. Respecto a esto, tanto las células cancerosas y los vasos, ya sea nuevos o cooptados, podrían representar el centro de la atención terapéutica.
Fuente bibliográfica
When Cancer Co-opts the Vasculature
Francesco Pezzella, M.D., and Adrian L. Harris, M.D., D.Phil.
Radcliffe Department of Medicine, Nuffield Division of Clinical Laboratory Science, John Radcliffe Hospital (F.P.), and the Molecular Oncology Laboratories, Department of Medical Oncology, Weatherall Institute of Molecular Medicine (A.L.H.), University of Oxford, Oxford, United Kingdom.
DOI: 10.1056/NEJMcibr1402407