Células madre transgénicas para regenerar la piel
La epidermolisis bullosa es una enfermedad genética severa y frecuentemente letal, causada por mutaciones en los genes que codifican laminina, glucoproteína de la membrana basal. Los pacientes que sobreviven con esta condición desarrollan heridas crónicas en la piel y mucosa, lo que deterioran su calidad de vida, pudiendo incluso causar cáncer de piel. Recientemente estudios mostraron que los cultivos de queratinocitos transgénicos autólogos son capaces de regenerar una epidermis entera y funcional en un niño de siete años que padecía una forma devastadora de esta enfermedad. El rastreo clonal de estas células mostró que la epidermis humana no está sustentada por progenitores equipotentes, sino por un número limitado de células madre de vida larga, dnominadas como holoclones, que pueden auto renovarse ampliamente en condiciones in vitro e in vivo y generar progenitores que reponen los queratinocitos diferenciados terminalmente. Este estudio proporciona un modelo que se puede aplicar a otras terapias génicas y celulares, lo que constituye un gran avance para combatir enfermedades genéticas potencialmente mortales.
Células madre y terapia génica
La terapia génica y el tratamiento con células madre a menudo se consideran el futuro de la medicina, pero ha habido muchas barreras para poner en práctica estos enfoques. De hecho, hay pocos ejemplos de terapias de células madre humanas verdaderamente útiles. En un reciente artículo, Hirsch y colaboradores describen un exitoso ejemplo: el uso de la terapia génica para corregir células de un niño que tenía una enfermedad genética devastadora asociada con ampollas en la piel (doi: 10.1038/nature24487).
La piel está compuesta por la epidermis, que actúa como una barrera contra el entorno externo, y la dermis subyacente, en la que la epidermis está firmemente anclada, confiriéndole elasticidad y resistencia mecánica. En la enfermedad epidermólisis ampollar, las mutaciones genéticas impiden la resistencia epidérmica normal o el anclaje, lo que hace que la piel sea frágil. El estrés mecánico y el trauma menor provocan fragmentación epidérmica o desprendimiento de la dermis, causando ampollas y úlceras en la piel. Esto produce heridas crónicas, dolorosas e intratables, y en última instancia conduce a cáncer de piel, infección y, en ocasiones, a la muerte. Actualmente no hay cura.
El grupo que realizó el estudio utilizó anteriormente la terapia génica para tratar una forma leve de epidermólisis causada por mutaciones en el gen laminina β3 (LAMB3), que codifica una proteína de anclaje epidérmico. En ese estudio, los autores aislaron una pequeña porción de epidermis de un paciente y agregaron una versión normal de LAMB3 a las células epidérmicas aisladas, utilizando un vector retroviral para transportar el gen al núcleo de las células. El vector se integró en el genoma de cada célula, lo que permitió una expresión normal de LAMB3. El grupo cultivó las células genéticamente corregidas in vitro para formar una pieza más grande de epidermis que fue posteriormente trasplantada en la pierna del paciente.
Los autores llevaron esta estrategia mucho más allá. Un niño de siete años que tenía una forma extremadamente severa de epidermólisis ampollar causada por mutaciones en LAMB3 ingresó en un hospital en una condición que ponía en peligro su vida, al haber perdido casi toda su piel. Se tomó una biopsia de 4 cm2 de una parte no afectada de su piel, y corrigieron genéticamente las células de este tejido mediante el uso de un vector retroviral que portaba LAMB3. Crecieron la población de células corregidas para obtener 0,85 m2 de injertos epidérmicos transgénicos. Reemplazaron el 80% de la piel del paciente con los injertos en tres operaciones separadas (figura 1). Después de 21 meses de seguimiento, el niño parecía haberse recuperado por completo, sin ampollas. Su piel era resistente al estrés y sanaba normalmente.
Una posible complicación de la terapia génica es que, debido a que el vector se integra en el genoma del hospedador en sitios aleatorios, puede alterar genes esenciales o desencadenar la sobreexpresión de genes que controlan el desarrollo tumoral. Para investigar esta posibilidad, se secuenció el ADN de la piel genéticamente corregida del paciente. La secuenciación reveló que la mayoría de las integraciones ocurrieron en secuencias que no codifican proteínas. Los genes contenidos en los vectores retrovirales no se han vinculado con el cáncer, lo que manifiesta la seguridad del enfoque.
A continuación, los autores compararon patrones de integración en cultivos in vitro corregidos con patrones en la epidermis regenerada in vivo, para determinar si patrones particulares (por ejemplo, integración en secuencias promotoras que dirigen la expresión génica) confirieron una ventaja de supervivencia celular que pudiera predisponer al cáncer en el futuro. Encontraron patrones similares en ambas condiciones, lo que indica que ni el protocolo de cultivo ni el recambio natural de células cutáneas condujeron a la supervivencia preferencial y la expansión de subconjuntos de células particulares. Finalmente, los investigadores no encontraron signos de producción de autoanticuerpos contra el transgén, lo que provocaría el rechazo del injerto, lo que demuestra aún más la seguridad del enfoque.
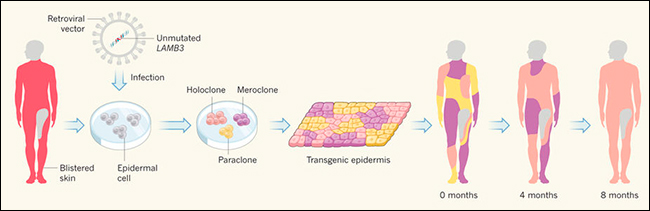
Figura 1. Terapia génica para tratar una enfermedad de la piel.
Hirsch y colaboradores utilizaron la terapia génica para tratar a un niño que había perdido el 80% de su piel debido a la epidermólisis ampollosa, una enfermedad que causa ampollas en la piel debido a la mutación del gen LAMB3. Los autores aislaron las células epidérmicas de una región cutánea no ampollosa y corrigieron las células infectándolas con un retrovirus portador de LAMB3 no mutado. El crecimiento in vitro de células epidérmicas produce tres tipos de colonias: holoclones, que son proliferativos y contienen células madre; colonias de paraclones diferenciadas; y meroclones, que se encuentran en un estado intermedio de diferenciación. El crecimiento adicional produce láminas de epidermis transgénica derivadas de estas colonias que pueden trasplantarse nuevamente al paciente. La piel se regenera por completo aproximadamente una vez al mes, con células diferenciadas reemplazadas. Después de cuatro meses, los autores descubrieron que muchas colonias de paraclones y meroclones del trasplante inicial se habían perdido y, a los ocho meses, casi toda la piel se derivaba de los holoclones iniciales. Por lo tanto, la piel es mantenida por unas pocas células madre.
La epidermis se renueva por completo aproximadamente una vez al mes. Si la renovación está garantizada por las células madre en la parte superior de una jerarquía celular, o si todas las células proliferativas se comportan como progenitores equipotentes, la elección aleatoria entre la proliferación y la diferenciación es un tema de debate. Cultivar células epidérmicas in vitro produce tres tipos de colonias de células: holoclones, paraclones y meroclones. Los holoclones son colonias proliferativas compuestas de células indiferenciadas que tienen capacidad de autorrenovación; los paraclones son células diferenciadas que tienen poca capacidad de renovación; y los meroclones son intermedios entre los dos. Aunque se ha formulado la hipótesis de que las colonias de holoclones contienen células madre epidérmicas, esta relación no se ha demostrado formalmente.
Los investigadores mapearon las posiciones de los sitios de integración viral en los genomas de los holoclones y los compararon con los sitios de integración en las células de la piel del niño cuatro y ocho meses después del injerto. Hubo muchos menos sitios de integración diferentes en las células biopsiadas tomadas a los cuatro meses que en los cultivos iniciales. Por el contrario, muchos sitios de inserción se conservaron entre las muestras de cuatro y ocho meses. Estos datos sugieren que la mayoría de las células presentes en el cultivo inicial se pierden durante los primeros cuatro meses, y solo unas pocas células madre contribuyen al mantenimiento epidérmico a largo plazo.
Además, hubo un aumento masivo en la frecuencia con la que los sitios de integración de holoclones aparecen en la piel rejuvenecida a lo largo del tiempo (esta piel contenía no solo holoclones, sino también paraclones y meroclones recién formados). Por lo tanto, las colonias de holoclones contienen células madre que repoblan la piel regenerada. Después de ocho meses, casi toda la epidermis se derivó de holoclones. Claramente, unas pocas células madre de larga vida sostienen la epidermis humana.
El estudio demuestra la viabilidad y seguridad de reemplazar toda la epidermis mediante el uso combinado de células madre y terapia génica. Además, el trabajo proporciona información sobre la jerarquía celular que rige el mantenimiento epidérmico en humanos. Pero hay varias consideraciones que deben abordarse antes de extender el tratamiento a otros pacientes.
La epidermólisis ampollosa puede ser causada por mutaciones en genes diferentes, no todos los cuales pueden ser fáciles de corregir. Se necesitarán estrategias como el uso de la tecnología de edición de genes CRISPR-Cas9 para corregir algunas mutaciones. También será necesario adaptar el procedimiento a diferentes sitios en el cuerpo, en particular en personas que tienen afecciones de la piel menos severas. El tratamiento podría ser más eficaz en niños, cuyas células madre tienen un mayor potencial de renovación y que tienen menos piel total para reemplazar en comparación a un adulto.
Finalmente, se necesitará un seguimiento a más largo plazo del niño en el estudio actual y de otros pacientes, para garantizar que no haya consecuencias adversas, por ejemplo, desarrollo de cáncer de piel o cambios que conduzcan a la pérdida de la expresión del transgén en algunas células, lo que podría dar lugar a zonas ampolladas. No obstante, el trabajo de los autores representa un gran paso en la búsqueda de terapias con células madre para tratar enfermedades.
Fuente bibliográfica
Gene therapy: Transgenic stem cells replace skin.
Mariaceleste Aragona & Cédric Blanpain
Laboratory of Stem Cells and Cancer, Université Libre de Bruxelles, 1070 Brussels, Belgium.
doi:10.1038/nature24753