Células madre: optimizadas para el trasplante
Durante el trasplante de células madre hematopoyéticas, se pierde un número considerable de células donantes debido a la apoptosis. Este proceso de muerte celular está mediado principalmente por las proteínas proapoptóticas BIM y BMF, cuya función es conservada entre las células progenitoras de ratones y humanos. La inhibición permanente de la apoptosis en las células donantes causada por la pérdida de estas proteínas solamente mejora el resultado del trasplante, pero los receptores pueden estar expuestos a un mayor riesgo de linfomagénesis o autoinmunidad. Recientemente, se determinó si la inhibición transitoria de la apoptosis puede servir como una alternativa segura y eficiente para mejorar el resultado del trasplante. Se demostró que el bloqueo de la muerte celular no sólo es suficiente para aumentar la viabilidad de la troncalidad de células hematopoyéticos durante su injerto sino que también mejora el resultado del trasplante sin signos de reacciones adversas. Por lo tanto, esta estrategia representa un enfoque terapéutico prometedor y novedoso, particularmente bajo condiciones de disponibilidad limitada de células madre de donantes.
Control de la apoptosis
El trasplante de células madre hematopoyéticas alogénicas (HSCT por sus siglas en inglés) es un enfoque potencialmente salvavidas que se utiliza para tratar enfermedades que van desde trastornos congénitos como la anemia de Fanconi al cáncer. La clave de cualquier trasplante es el éxito en el injerto donante-célula y la funcionalidad en el destinatario. Con el HSCT alogénico, las células madre hematopoyéticas (HSC, del inglés hematopoietic stem-cell) donantes deben tener tanto capacidad de auto-renovación y de diferenciación multipotencial, o "troncalidad," para generar continuamente linajes mieloides y linfoides funcionales. Debido a que pueden ocurrir reacciones contra el hospedero y reacciones de éste último contra el injerto después del HSCT alogénico, se requieren procedimientos adecuados para minimizar estas situaciones sin afectar la función de las células trasplantadas.
Las fuentes de HSC incluyen la médula ósea, sangre periférica, y sangre de cordón umbilical. El número y la calidad de las CEH influyen directamente en la extensión del injerto y reconstitución. El número y calidad de las HSC afecta directamente el alcance del injerto y la reconstitución. El número de HSC es inherentemente limitado en unidades de sangre de cordón umbilical, necesitando múltiples unidades de diferentes donantes. Por lo tanto, se trata de un problema importante en el HSCT, que refiere a la supervivencia de las HSC después de la infusión y su capacidad de repoblar el nicho hematopoyético.
Desafortunadamente, las HSC, cuando se toman de su ambiente normal, comienzan a morir por apoptosis y siguen haciéndolo incluso después de la reinfusión. De hecho, quitar las células de su entorno, privándolas de citoquinas, manipulándolas y congelándolas (en el caso de cordón umbilical sangre), descongelándolas, y luego infundiéndolas, se las expone a estresantes físicos todos con un efecto negativo sobre la supervivencia celular (figura 1). Otro factor estresante es la resistencia inmune del huésped. La administración de factores de crecimiento hematopoyéticos pueden mejorar parcialmente el injerto y la reconstitución, pero los efectos fuera de objetivo plantean dificultades.
Existe una fina línea divisoria entre la promoción de la supervivencia, proliferación y diferenciación multipotencial de las HSC y la promoción de la diferenciación con pérdida de troncalidad. Los intentos para hacer que el donante de las HSC sea resistente a la apoptosis mediante la inhibición de estas rutas celulares promueven con éxito el injerto, pero también han resultado en linfomagénesis y autoinmunidad. Otro enfoque, la eliminación selectiva de genes que actúan como mediadores de la apoptosis, a través de un vector viral, podría llevar a la mutagénesis de inserción y transformación maligna.
Por lo tanto, una estrategia atractiva consistiría en suprimir transitoriamente la apoptosis de las HSC durante el período inicial de transferencia, con el fin defavorecer el injerto. Las HSC han sido expuestas experimentalmente a proteínas de fusión antiapoptótica en condiciones in vitro, lo que ha resultado en una incorporación transitoria que se pierde después de 72 horas pero que también resulta en una protección contra la apoptosis y en la reconstitución linfoide exitosa cuando las HSC son administradas a ratones inmunodeficientes. Aunque la repoblación competitiva y el trasplante en serie no se han llevado a cabo en estudios y la reconstitución de multilinaje (mieloide y linfoide) no se ha logrado en ratones, un ensayo clínico reciente ha iniciado un análisis en pacientes con inmunodeficiencia grave combinada.
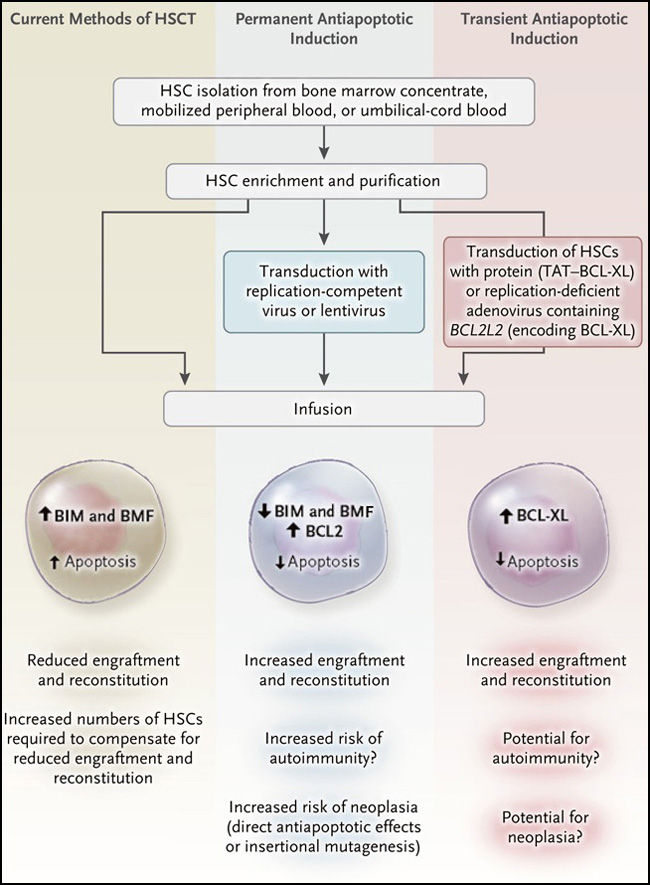
Figura 1. Ajustando las células madre hematopoyéticas.
Los protocolos actuales para el trasplante de células madre hematopoyéticas (HSCT) implican obtener una fuente de HSC de un tejido (médula ósea, sangre periférica movilizada, o sangre umbilical) seguida de una purificación y enriquecimiento, posible congelación y descongelamiento, y luego infusión. Debajo de estos factores estresantes, las células se vuelven cada vez más susceptibles a la apoptosis (mediada, en parte, por las proteínas BIM y BMF) lo que da lugar a un injerto subóptimo, y cuando existen un número limitado de HSC, falla el injerto y ocurre un deterioro de la reconstitución. Un par de enfoques experimentales han sido diseñados para prevenir la apoptosis de las HSC. Uno de los enfoques consiste en reducir permanentemente las proteínas proapoptóticas BIM y BMF o sobrerregular la proteína antiapoptótica BCL2. Estos enfoques dan como resultado un aumento del injerto, pero también conducen a un mayor riesgo de autoinmunidad o transformación. Kolleky colaboradores (doi: 10.1084/jem.20161721) reportaron recientemente un enfoque diferente: la focalización transitoria de estas rutas usando proteínas de fusión o construcciones virales defectuosas en su replicación. Mostraron que la protección contra la apoptosis de las HSC durante el injerto inicial resultó en repoblación y reconstitución exitosa trasplante en un modelo de ratón, sin aumentos evidentes de tumorigénesis.
Un estudio reportado recientemente por Matthias Kollek y colaboradores (doi: 10.1084/jem.20161721) evidenció que miembros de la familia proteica proapoptótica BCL2, BIM y BMF median la apoptosis de las HSC en condiciones de estrés. Utilizaron 2 enfoques para proteger a las HSC de la muerte: una infección y transducción de HSC de ratón con un vector adenoviral defectuoso de replicación que contenía el gen que codifica la proteína antiapoptótica BCL-XL. Además se administró directamente la proteína TAT-BCL-XL en HSC humanas y de ratones. Estos enfoques permitieron la expresión transiente de BCL-XL en HSC transfectadas, por lo tanto se bloqueó específicamente la cascada apoptótica que mediada por BIM y BMF (figura 1).
Los resultados fueron impresionantes. Se detectó una expresión marcada pero transitoria de BCL-XL tanto en HSC humanas como de ratones, que declinó después de 9 días cuando se utilizó cualquiera de los dos enfoques. Esto resultó en el fomento de la supervivencia celular y en una mejora de la capacidad de las células para diferenciarse in vitro bajo condiciones de estrés. También se logró un aumento del injerto con reconstitución multilinaje duradera (tanto mieloide como linfoide) cuando las HSC fueron infundidas en ratones letalmente irradiados. Estudios de repoblación competitiva con HSC congénitas mostraron que la transducción de proteínas con BCL-XL mejora la capacidad de las HSC para el injerto y repoblamiento de la médula de los ratones receptores. Los autores no observaron ningún aumento en la linfomagénesis, ni siquiera cuando usaron HSC de ratones propensos a linfoma.
Aunque estos resultados son alentadores, existen preguntas que deben ser tratadas antes de considerar una prueba de este enfoque en la clínica. La transducción de proteínas parece ser superior a la transducción adenoviral, sin embargo, la duración de expresión puede ser más corta. Pese a ello, la mantención de la troncalidad en ratones irradiados necesita ser analizada con experimentos que involucren un trasplante serial secundario y terciario con números más pequeños de HSC.
Aunque se observó una pérdida de expresión de BCL-XL después del trasplante, los ensayos de expresión están limitados por la sensibilidad de las técnicas que se utilizan para medir los niveles de proteína en muestras de HSC. También será necesario para "empujar" aún más lejos el modelo preclínico una evaluación del riesgo de cáncer (por ejemplo, a través de la exposición a agentes carcinógenos o radioterapia). Además, será importante que se haga una evaluación rigurosa de cualquier potencial de mutagénesis de inserción o susceptibilidad a la transformación maligna, Aquí es donde los estudios de un modelo animal grande (perro o primate no humano) pueden proporcionar más pistas. Una preocupación adicional es la posibilidad de que inmunidad preexistente al adenovirus puedan provocar una reacción del huésped contra el injerto.
También quedan preguntas sobre los diferentes controles de la apoptosis en las HSC. No se conoce la extensión y duración de la expresión BCL-XL necesaria para una protección óptima o incluso mínima, y sólo se puede extrapolar la cinética del injerto y la reconstitución en ratones a la situación clínica de forma muy general. Finalmente, la verdadera prueba de estos resultados residirá en sistemas alogénicos en los que puede ocurrir la resistencia del huésped. Posiblemente las células transducidas pueden inicialmente ser resistentes al rechazo inmunológico debido al escudo antiapoptótico. Esto plantea cuestiones como si podría utilizarse esta forma de protección para otros tipos de células y aplicaciones de terapia celular. De esta forma, estudios como el reportado Kollek y colegas sugieren que a medida que se entiende más de la biología de las células en condiciones normales y limitantes, se puede determinar mejor las vías y moléculas involucradas para controlar su estimulación en el momento oportuno para obtener ventajas terapéuticas.
Fuente bibliográfica
Making a Better Hematopoietic Stem Cell — Timing Is Everything
William J. Murphy, Ph.D.
Dermatology and Internal Medicine, Division of Hematology/Oncology, University of California Davis School of Medicine, Sacramento.
DOI: 10.1056/NEJMcibr1713508