¿Otro mecanismo de resistencia al tratamiento de la leucemia?
INTRODUCCIÓN
La leucemia linfoblástica aguda infantil (llamada también leucemia linfocítica aguda o simplemente LLA) es la forma más frecuente de cáncer en la niñez. Constituye el 25% de todos los cánceres en la edad pediátrica y aproximadamente el 75% de todos los casos de leucemia. Afecta a los linfocitos, un tipo de glóbulos blancos. La médula ósea controla la producción de los glóbulos sanguíneos, pero aquí, la producción normal falla. La médula empieza a generar un gran número de glóbulos blancos anormales e inmaduros denominados linfoblastos o blastos, las células leucémicas se acumulan en la médula ósea, reemplazan las células sanguíneas sanas, y se diseminan a otros órganos, entre los que se encuentran el hígado, el bazo, los ganglios linfáticos, el sistema nervioso central, los riñones y las gónadas. En los Estados Unidos, alrededor de 3.000 niños al año se diagnostican con la enfermedad y su incidencia máxima se observa entre los 3 y los 5 años de edad, afectando a un número ligeramente superior de niños que de niñas.
Respecto al tratamiento, la quimioterapia se utiliza para eliminar las células leucémicas, la cual concluye luego de dos a tres años. El trasplante de células madre hematopoyéticas es una opción para los pacientes de muy alto riesgo o aquellos que desarrollan una recaída precoz a nivel medular. En particular, la enzima L-asparaginasa se integra en todos los esquemas de tratamiento, ella es parte fundamental del manejo, e incluye diversas dosis en los manejos terapéuticos. Su uso intensivo da lugar a mejores tasas de respuesta, aunque puede acompañarse de formación de anticuerpos anti-asparaginasa y reacciones de hipersensibilidad pudiendo o no implicar el desarrollo de resistencia al efecto de la enzima. Su administración a veces va acompañado de eventos tromboembólicos graves, que se da con una incidencia del 2.4 al 11.5%. Lamentablemente, una proporción importante de pacientes con LLA presentan recaída o resistencia a la quimioterapia (como parte de un proceso de adaptación celular que depende del componente genético y polimórfico de cada individuo) muriendo finalmente como consecuencia de las complicaciones de la enfermedad.
Resistencia al tratamiento de la leucemia linfoblástica aguda
Durante las últimas tres décadas, los investigadores han estado estudiando las interacciones entre las células madre hematopoyéticas y las células circundantes de la médula. El área donde ocurren estas interacciones se llama microambiente hematopoyético. Tales interacciones son clave para el mantenimiento de las células madre hematopoyéticas y no suceden aleatoriamente en la cavidad de la médula; sino, que preferencialmente en diversos lugares dentro de este espacio, de ahí la frase “nicho de células madre”. Un nicho de células madre es una acumulación de células madre hematopoyéticas en un lugar particular que mantiene la supervivencia y la función de las células a través de las interacciones célula-célula y célula-matriz. Un estudio reciente de Shotaro Iwamoto y colaboradores (J Clin Invest 2007; 117:1049-57) define un aspecto bioquímico de este microambiente que puede ser importante en la terapia de la leucemia linfoblástica aguda.
Se cree, cada vez con mayor fuerza, que las células madre hematopoyéticas y las células madre leucémicas (aquellas células responsables del mantenimiento y del resurgimiento de la enfermedad después de la eliminación de los blastos leucémicos) interactúan con las células no hematopoyéticas del microambiente de la médula ósea. Por ejemplo, las células leucémicas de la LLA y de la leucemia mielógena crónica obran recíprocamente con el microambiente hematopoyético a través de múltiples proteínas de la superficie celular, incluyendo la CD44. El bloqueo de CD44, el cual ha sido implicado en la adherencia normal de las células madre hematopoyéticas, anula estas interacciones y retrasa la progresión de la leucemia en los modelos de ratón para la enfermedad.
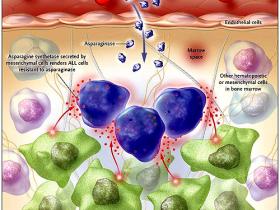
El grupo de Shotaro Iwamoto ha permitido entender mejor el concepto de nicho de las “células madre leucémicas”. Ellos demostraron que las células estromales (también denominadas células mesenquimales) generan y secretan grandes cantidades de asparagina sintetasa, una importantísima enzima en la biosíntesis del aminoácido esencial asparagina. Si bien no se ha determinado la relevancia de la asparagina sintetasa en la biología de la leucemia linfoblástica aguda, son evidentes las implicaciones terapéuticas para cualquier persona que haya tenido que cuidar niños con este mal. La asparaginasa, que reduce las células de asparagina, durante muchos años se ha utilizado para tratar la LLA, contribuyendo considerablemente a mejores resultados del tratamiento. Los estudios clínicos han demostrado una relación directa entre el efecto en la LLA y la intensidad de la dosis con asparaginasa. Sin embargo, se desconocen los errores de los mecanismos subyacentes y el por qué la resistencia al tratamiento con asparaginasa.
Iwamoto y colaboradores pensaban que la interacción entre los blastos leucémicos y las células mesenquimales de la médula ósea pueden proporcionar un ambiente “protector” para los blastos de la LLA contra el tratamiento con asparaginasa. Con el uso de pruebas genéticas y análisis bioquímicos, los investigadores demostraron que las células mesenquimales de la médula expresan cantidades perceptiblemente más altas de asparagina sintetasa que las células de blastos leucémicas (figura 1). Ellos entonces observaron que la resistencia a la asparaginasa de las líneas celulares leucémicas y de algunas formas de leucemia primaria se correlacionaba con la expresión de la asparagina sintetasa a través de las células mesenquimales. La manipulación de la actividad de la asparagina sintetasa en una variedad de células mesenquimales (por la sobre-expresión o por el “knock-down”) da lugar al efecto predicho en la sensibilidad de la asparaginasa. Es decir, la mayor expresión de la asparagina sintetasa por las células mesenquimales genera una resistencia creciente de las células LLA; inversamente, la menor expresión de la enzima por las células mesenquimales provoca mayor sensibilidad de las células LLA.
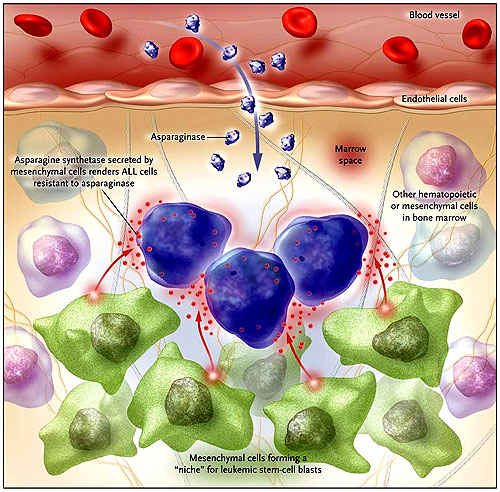
Un reciente estudio realizado por Iwamoto y colegas sugiere que la asparagina sintetasa, producida en grandes cantidades por las células mesenquimales de la médula ósea, protege a los blastos leucémicos contra los efectos del tratamiento con asparaginasa. La proximidad de los blastos a las células mesenquimales probablemente facilita este resultado “protector”; en donde no parece ser necesario el contacto directo entre las células (adaptado de una figura proporcionada por el Dr. Hartmut Geiger).
Los autores no demostraron que esta asociación in vivo sea crítica y que la relación entre las células leucémicas y la célula mesenquimal mantenga una mínima enfermedad residual en la leucemia linfoblástica aguda. El debate está abierto para dilucidar si existe una verdadera célula madre leucémica en esta patología. Un planteamiento terapéutico también requeriría el desarrollo de técnicas apropiadas que apunten a la inhibición de la asparagina sintetasa en el microambiente de la médula ósea. Por lo tanto, hay grano para moler en el molino de la investigación; ésta debe ser realizada antes de que sepamos si este nuevo descubrimiento se puede traducir en nuevas terapias. Sin embargo, uno podría imaginar que al centrarse en las células de la LLA mediante la reducción de la expresión de la asparagina sintetasa por la célula mesenquimal de la médula es posible mejorar el resultado en pacientes con la enfermedad.
Fuente bibliográfica
A New Mechanism of Leukemia Drug Resistance?
David A. Williams, M.D.
Division of Experimental Hematology, Cincinnati Children's Hospital Medical Center, University of Cincinnati College of Medicine, Cincinnati, USA.
N Engl J Med. 2007 Jul 5; 357(1):77-8