Vitrificación permite la criopreservación de órganos a largo plazo en modelo de rata
El almacenamiento de órganos crioconservados podría transformar el trasplante en un procedimiento planificado que llegue de forma más equitativa a los pacientes.
La capacidad de crioconservar de forma intencionada y reproducible sistemas biológicos vivos, como células, tejidos, órganos e incluso organismos enteros, comenzó en 1949 con la conservación de espermatozoides de aves de corral utilizando glicerol, un agente crioprotector (CPA) que los protegía durante la congelación.
Estos y otros estudios también demostraron que las lesiones provocadas por la cristalización del hielo durante la congelación limitaban el éxito, sobre todo en sistemas de mayor tamaño. Los esfuerzos para superar este obstáculo condujeron a la "vitrificación", un enfoque que utiliza concentraciones más altas de CPA y velocidades de enfriamiento más rápidas que evitan por completo la cristalización mediante la formación de un estado vítreo durante el enfriamiento, como se ha demostrado tanto en embriones como en riñones enteros de conejo.
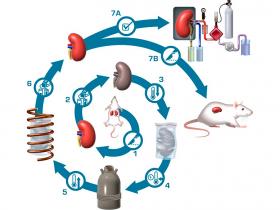
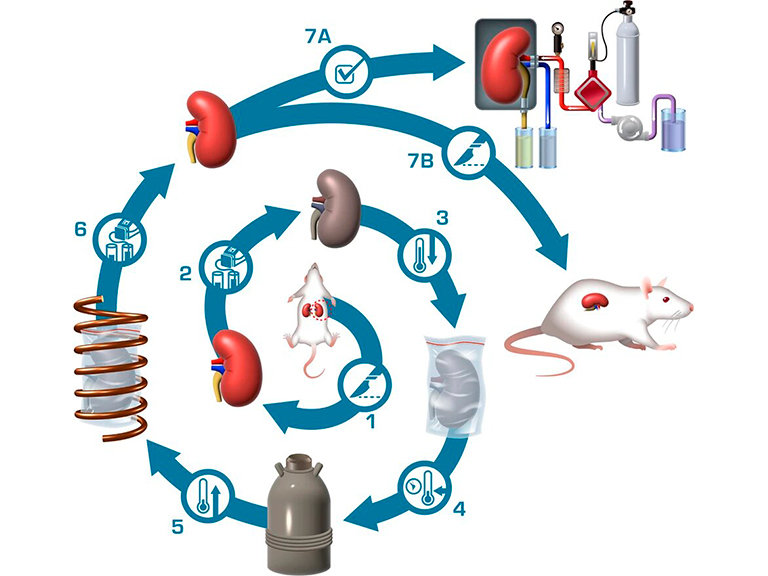
Cuando el tejido se congela, se forman cristales de hielo entre las células, lo que provoca daños. Para superar este problema, un grupo de investigadores de la Universidad de Minnesota (EEUU) utilizaron una técnica llamada congelación rápida, en la que se inyectan sustancias químicas crioprotectoras en el tejido, que luego se congela muy rápidamente. En lugar de cristales, se formaba un material similar al vidrio que no causaba daños. El equipo se centró entonces en el proceso de descongelación.
La mayoría de las técnicas de este último proceso consisten en dejar la muestra a temperatura ambiente hasta que se descongele, a veces aplicando calor o incluso utilizando microondas. Por desgracia, todas estas técnicas adolecen del mismo problema: la descongelación desigual, en la que el tejido se calienta a ritmos diferentes en el mismo órgano. El resultado son grietas o desgarros que terminan por inutilizarlo. Para superarlo el equipo inyectó partículas de óxido de hierro en un órgano antes de congelarlo. A continuación, utilizaron campos magnéticos alternos para calentar el tejido a temperatura ambiente: cada una de las nanopartículas actuaba como un pequeño calentador. El resultado fue un tejido descongelado uniformemente.
Para probar su técnica, congelaron varios riñones de rata y los mantuvieron congelados hasta 100 días. Después los deshielaron, limpiaron las sustancias químicas y las nanopartículas e implantaron cinco de ellos en ratas vivas. Las pruebas demostraron que todos los roedores sobrevivieron al procedimiento y recuperaron la función renal completa a los 30 días de su trasplante.
Se necesitan más pruebas antes de poder realizar ensayos similares en humanos, pero los investigadores sugieren que su trabajo podría mejorar significativamente las posibilidades de que los pacientes que necesitan un órgano lo reciban antes de que se les acabe el tiempo.