Freno mitocondrial a la reparación vascular
Los mecanismos fisiológicos que controlan la actividad mitocondrial en el contexto del metabolismo y crecimiento celular aún no son comprendidos en su totalidad. Recientes estudios realizados en modelos animales y bajo condiciones in vitro han evidenciado que una proteína atípica del tipo cadherina, denominada Fat1, actúa como un "freno" molecular sobre la respiración mitocondrial que regula la proliferación de células de la musculatura lisa (CML) tras una lesión arterial. Además, se ha observado que fragmentos de Fat1 se acumulan en las mitocondrias de este tipo celular y el dominio intracelular de la proteína interacciona con múltiples proteínas mitocondriales, incluidos factores críticos asociados con la membrana mitocondrial interna. Las CML que carecen de Fat1 (Fat1 KO) crecen más rápido y consumen más oxígeno para la producción de ATP. En particular, la expresión en células Fat1KO de un dominio intracelular modificado que se localiza exclusivamente en las mitocondrias, normaliza en gran medida el consumo de oxígeno y la proliferación desmedida de estas células puede suprimirse mediante la inhibición de la respiración mitocondrial, lo que sugiere un mecanismo intrínseco de control del crecimiento mediado por Fat1. Estos hallazgos postulan que Fat1 controla la actividad mitocondrial para restringir el crecimiento celular durante el estado reparativo y proliferativo inducido durante una lesión vascular, lo que además podría tener relevancia para la comprensión de otros trastornos relacionados con el metabolismo y crecimiento celular.
Protección antiproliferativa
Después de una lesión a las células que delimitan las paredes de vasos sanguíneos, las células del músculo liso vascular (CMLV) se trasladan al sitio de la herida y proliferan para cubrirlo. Sin embargo, la sobre proliferación en el sitio de reparación podría causar engrosamiento de la pared del vaso lo que reduce el flujo sanguíneo. Además de los daños naturales, la lesión de un vaso sanguíneo puede ser producto de intervenciones quirúrgicas como trasplantes o procedimientos para abrir vasos sanguíneos angostos. La comprensión de las señales que regulan la proliferación de las CMLV podría permitir el desarrollo de enfoques clínicos para limitar este proceso y prevenir el estrechamiento de los vasos sanguíneos. En un reciente artículo Longyue Cao y sus colegas (Nature. 2016 Nov 24;539(7630):575-578) demostraron que el receptor Fat1, una proteína que regula negativamente la proliferación de CMLV, cumple un rol inesperado en la modulación de la síntesis energética mitocondrial.
Fat1 es un miembro de las Fat Cadherinas de vertebrados, una pequeña familia de proteínas cuya función primaria no está clara. Trabajos previos han mostrado que Fat1 mejora la migración y limita la proliferación de CMLV, proporcionando pistas sobre su posible rol en la remodelación de células vasculares.
El receptor Fat1 está normalmente presente en la superficie celular, y su estructura consiste en un dominio extracelular, un segmento transmembrana y un dominio intracelular. Cao y sus colaboradores utilizaron espectrometría de masas para identificar proteínas que interactúan con el dominio intracelular de Fat1 en ratones. Descubrieron que 22 macromoléculas interaccionaban con Fat1 y éstas correspondían a proteínas de la membrana interna de la mitocondria.
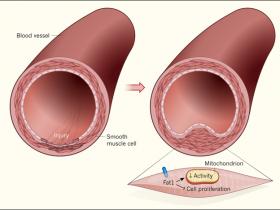
Los investigadores probaron y validaron sus hallazgos utilizando una variedad de técnicas. Los autores observaron que Fat1 está presente dentro de las mitocondrias de las CMLV. También encontraron que las porciones incompletas de Fat1 se localizan en abundancia en las mitocondrias, y que éstas interaccionan directamente con proteínas de la maquinaria respiratoria mitocondrial encargada de la síntesis de ATP. Análisis subsecuentes en ratones revelaron que las CMLV que carecían de Fat1 tenían una mejor función respiratoria mitocondrial, en ausencia de otras alteraciones. Por ende, los autores concluyeron que Fat1 disminuye la respiración mitocondrial para suprimir la proliferación de las CMLV (Figura 1).
La importancia de la función mitocondrial para la capacidad proliferativa de las CMLV ya era conocida. Pero, ¿qué tan relevante es la señalización de Fat1 para la regulación mitocondrial necesaria para permitir la reparación del daño vascular? Los investigadores establecieron la relevancia de esta vía en tejidos humanos a través de estudios in vitro, en los que se demostró que FAT1 humana puede regular la respiración mitocondrial y la proliferación de las CMLV en vasos sanguíneos arteriales. Los autores también estudiaron la expresión de FAT1 en estas células de humanos en el contexto de reparación arterial, basándose en muestras de arterias post-mortem de personas que se habían sometido a una inserción quirúrgica de un estent para corregir la aterosclerosis.
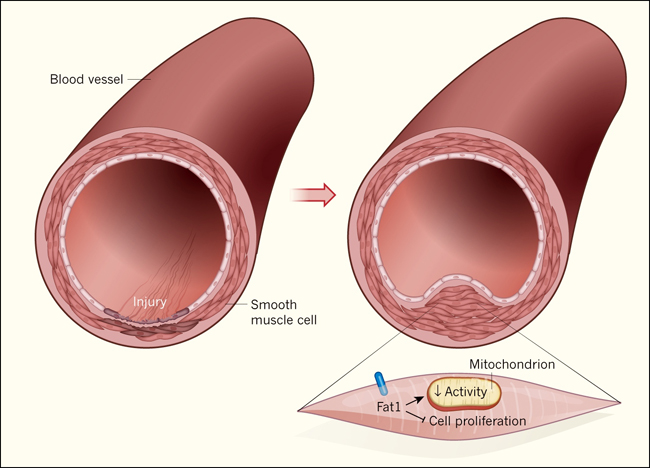
Figura 1: Fat1 avanza con el flujo.
Las lesiones en las paredes de los vasos sanguíneos pueden ocurrir por causas naturales o ser causadas por intervenciones quirúrgicas. Las células musculares lisas vasculares (CMLV) migran al sitio dañado y proliferan como parte de la respuesta curativa. Sin embargo, esto puede resultar en una sobre proliferación celular, causando engrosamiento de la pared vascular y estrechamiento del vaso sanguíneo. El receptor proteico Fat1 (azul) limita la proliferación de las CMLV. En estudios realizados con ratones y células humanas, Cao y sus colegas reportan que una porción de Fat1 interactúa con las proteínas de las mitocondrias e inhibe la actividad mitocondrial en las CMLV.
Además, investigaron un modelo de lesión arterial usando ratones cuyas células de la musculatura lisa carecían del gen Fat1. Las arterias dañadas en estos ratones se volvieron significativamente más estrechas que los controles, lo que permitió establecer que la presencia de Fat1 normalmente limita el potencial de las CMLV para contribuir al bloqueo vascular. Sin embargo, aunque este modelo puede ser relevante para muchos aspectos de la proliferación y remodelación de células vasculares, no refleja todos los procesos involucrados en la enfermedad vascular. A pesar de ello, este trabajo establece un marco para promover la investigación sobre Fat1 y sus vías de señalización mitocondrial.
Para Fat1 se han propuesto además diversos roles en estados patológicos. El cáncer es de particular interés, dado que los estudios en la mosca Drosophila melanogaster indican que Ft, una versión de Fat1 en esta especie, es un gen supresor de tumores. Tal función es consistente con estudios de represión o inactivación de FAT1 en ciertos cánceres humanos, en los que su pérdida puede resultar en la señalización promotora de tumores mediada por la proteína Wnt.
Sin embargo, FAT1 se sobreexpresa en algunos tipos de cáncer, creando un enigma sobre si esta proteína promueve o inhibe tumores. FAT1 podría ser sobreexpresada en estas circunstancias porque las células tumorales necesitan escapar de la destrucción por procesos de muerte celular y los altos niveles de FAT1 protegen contra la apoptosis. FAT1 es también sobrerregulada en condiciones hipóxicas. Un ambiente celular estresante que resulta de la hipoxia, a menudo es producido en casos de tumores sólidos, y tal vez la sobrerregulación de FAT1 permite que las células tumorales sobrevivan bajo estas condiciones. Como suele ocurrir en biología, la determinación de la acción de una proteína requiere observaciones que se deben colocar en el contexto. El desafío es descubrir si la función de Fat1 en el control de la respiración mitocondrial es relevante para el cáncer humano.
Descubrir cómo Fat1 está regulada es un punto clave para futuras investigaciones. Las porciones más pequeñas de Fat1, más que la proteína completa se asocian con las mitocondrias. Esta observación sugiere que Fat1 sufre un clevaje enzimático para entrar en este organelo. Fat1 es sustrato del complejo proteico γ-secretasa, proteasa que escinde y libera los dominios citoplasmáticos de la región transmembrana, aunque los autores no investigaron la escisión de Fat1. Tampoco se sabe si algún tipo de ligando se une al dominio extracelular de Fat1. Dado que las células endoteliales en las paredes de los vasos sanguíneos perciben daños mecánicos y transmiten esta información a las CMLV adyacentes, el endotelio podría señalizar y comunicarse vía Fat1, pero se desconoce mediante qué tipo de ligando se llevaría a cabo esta actividad. Finalmente, la descripción de tales aspectos de la regulación de FAT1 serán necesarias para entender el potencial terapéutico de esta vía de señalización para que pueda ser explotada a nivel clínico.
Fuente bibliográfica
Cell biology: A mitochondrial brake on vascular repair
Charles E. de Bock & Rick F. Thorne
VIB Center for the Biology of Disease, Leuven 3000, Belgium and the University of Newcastle, Australia.
doi:10.1038/nature20476