Una revisión profunda al receptor GABAA
Los receptores del ácido γ-aminobutírico tipo A (GABAA) son canales de cloruro vinculados con una farmacología muy variada. Algunos de sus moduladores, como las benzodiacepinas y los anestésicos generales, se encuentran entre los fármacos de mayor éxito en el uso clínico, pero también son sustancias comunes de abuso. Sin datos estructurales fiables, la base mecanicista para la modulación farmacológica de los receptores GABAA sigue siendo en gran medida desconocida. Recientemente, diversos estudios han reportado varias estructuras mediante microscopía crioelectrónica de alta resolución en las que el receptor GABAA, dispuesto en nanodiscos lipídicos, se analiza unido a picrotoxina (bloqueadora de canales), al antagonista competitivo bicuculina, al agonista GABA, y a las clásicas benzodiazepinas alprazolam y diazepam. Se describen los modos de unión y los efectos mecanísticos de estos ligandos, los estados cerrados y desensibilizados del ciclo de apertura del receptor GABAA, y la base para el acoplamiento alostérico entre la región extracelular de unión al agonista y la región transmembrana que forma el canal. Estos estudios proporcionan un marco estructural en el que se integra la investigación previa en fisiología y farmacología y una base estructural detallada para el potencial desarrollo de nuevos moduladores de los receptores GABAA.
Farmacología estructural
La actividad del sistema nervioso central está regulada por moléculas excitadoras e inhibidoras llamadas neurotransmisores, que median la comunicación entre las neuronas. El principal neurotransmisor inhibidor en el cerebro humano es ácido γ-aminobutírico (GABA), que se une a varios receptores, incluyendo el receptor GABAA. Las mutaciones que afectan a estos receptores pueden causar trastornos neurológicos como la epilepsia. Los receptores GABAA también tienen sitios de unión para muchas otras moléculas que actúan como ligandos, algunas de las cuales son medicamentos ampliamente utilizados. La unión de ligandos a sitios diferentes de los que se une GABA, puede afectar la conformación del receptor de manera que se puede estimular o inhibir su función (modulación alostérica). En dos recientes estudios, Laverty y cols. (DOI: 10.1038/s41586-018-0833-4) y Masiulis y cols. (DOI: 10.1038/s41586-018-0832-5) dan a conocer las estructuras 3D de alta resolución de una isoforma del receptor GABAA unida a diferentes ligandos en conformaciones fisiológicamente relevantes. Su trabajo arroja luz sobre la intrincada red de diafonía a corta y larga distancia entre los distintos sitios de unión del receptor, y es probable que estimule la investigación para el descubrimiento de fármacos.
Los receptores GABAA son una familia de complejos proteicos que abarcan la membrana celular de las neuronas. Se componen de cinco subunidades (la mayoría de las veces dos α, dos β y una γ) dispuestas de forma casi simétrica alrededor de un canal central. Cada subunidad tiene tres dominios: el extracelular, transmembrana e intracelular. El GABA se une a la parte extracelular del receptor, en las interfaces entre las subunidades α y β Esto lleva a cambios conformacionales que hacen que el canal se abra y que los aniones de cloruro fluyan a través de él. Las benzodiacepinas -un grupo de fármacos que incluye varios sedantes y ansiolíticos ampliamente utilizados- se unen a un sitio extracelular entre las subunidades α y γ, mientras que la parte transmembrana del receptor alberga sitios de unión para alcoholes, anestésicos y neurosteroides.
Los investigadores de ambos grupos utilizaron microscopía crioelectrónica (cryo-EM) para estudiar una isoforma de GABAA que contiene dos subunidades α1, dos β3 y una γ2 dispuestas en el orden α1-β3-γ2-α1-β3. Esta es una de las isoformas más abundantes del receptor GABAA en el cerebro humano. Aunque se conocía la arquitectura general del receptor, los estudios proporcionan una nueva visión de los detalles moleculares de la arquitectura y el ensamblaje de la subunidad, la ubicación de los sitios de unión del modulador y los cambios conformacionales iniciados por la unión de ligandos.
El estudio de Laverty y cols. tiene tres nuevos aspectos metodológicos. En primer lugar, los autores utilizaron subunidades completas del GABAA, no las subunidades truncadas utilizadas en estudios anteriores. En segundo lugar, reconstituyeron los receptores en membranas discoidales (nanodiscos) compuestas de una doble capa de moléculas de lípidos rodeadas de proteínas, un entorno similar al de la membrana celular natural (figura 1). Esto contrasta con el ambiente de detergente que se ha utilizado en la gran mayoría de los estudios previos.
Tercero, los receptores fueron acoplados a un anticuerpo agrandado sintéticamente (llamado megabody) para ayudar a su orientación y alineación durante la imagenología crio-EM. Utilizando esta metodología, Laverty y cols. resolvieron la estructura del receptor unido al GABA, mientras que Masiulis y cols. resolvieron cinco estructuras adicionales con diferentes ligandos o combinaciones de ellos: picrotoxina (un agente que bloquea el canal abierto del receptor); picrotoxina y GABA; bicuculina (un fármaco que induce síntomas de epilepsia); alprazolam (una benzodiacepina) y GABA; y diazepam (otra benzodiacepina) y GABA.
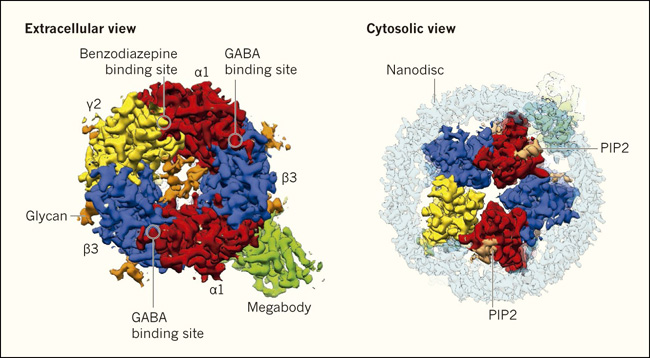
Figura 1. Estructura de un receptor GABAA compuesto por dos subunidades α1, dos β3 y una γ2.
Laverty y cols. (DOI: 10.1038/s41586-018-0833-4) y Masiulis y cols. (DOI: 10.1038/s41586-018-0832-5) determinaron las estructuras de una de las isoformas del receptor GABAA más abundantes en el cerebro humano, solas o unidas a varios ligandos, mediante microscopía crioelectrónica. Antes de la obtención de imágenes, reconstituyeron el receptor dentro de una membrana lipídica (nanodisco) que imita la membrana celular de las neuronas, el entorno natural del receptor. El receptor también fue acoplado a un anticuerpo agrandado (megabody) para permitir una mejor orientación durante la imagenología. La porción extracelular del receptor contiene sitios de unión para el ácido aminobutírico (GABA), un ligando natural, y para benzodiacepinas. La estructura también indica los sitios de algunas moléculas generalmente asociadas con el receptor, como el fosfatidilinositol 4,5-bisfosfato (PIP2) y los glicanos (azúcares adheridos al receptor).
Los receptores GABAA son conocidos por requerir un ambiente lipídico para sufrir transiciones conformacionales funcionale. Recientemente, otros dos estudios (DOI: 10.1038/s41586-018-0255-3; DOI: 10.7554/eLife.39383) determinaron las primeras estructuras de receptores GABAA heterotriméricos. En ambos estudios, el dominio transmembrana del receptor estaba en una conformación antinatural, que podría haber sido causada por la sustitución del entorno de membrana natural por un detergente. Dada la naturaleza alostérica del receptor GABAA, cualquier alteración conformacional de la estructura del dominio transmembrana de una o unas pocas subunidades podría afectar los dominios transmembrana de otras subunidades, y potencialmente también los dominios extracelulares. Por lo tanto, las nuevas estructuras obtenidas en un ambiente de membrana podrían ser una representación más cercana de las conformaciones naturales de los sitios de unión del receptor. En particular, Laverty y cols. demostraron que su método de reconstitución de receptores preservaba la diafonía fisiológica a larga distancia entre diferentes sitios de unión de ligandos: la variación de la cantidad de un ligando dado unido al receptor modulaba la unión de un ligando diferente, marcado radiactivamente, a un sitio distante.
Los autores de ambos estudios incubaron las muestras del nanodisco receptor GABAA con el megabody para orientar los complejos GABAA-megabody durante la crio-EM de tal manera que se pudieran obtener instantáneas desde diferentes ángulos. El uso de megabodies también podría ser un avance tecnológico porque puede aumentar el tamaño de complejos proteicos que de otra manera serían demasiado pequeños para que sus estructuras se determinen utilizando crioEM.
Los hallazgos muestran cómo la unión de un ligando a su sitio conduce a cambios conformacionales y funcionales a través del receptor GABAA, incluyendo cambios en los sitios de unión de otros ligandos. Por ejemplo, una estructura muestra que la unión de GABA a sus dos sitios en el dominio extracelular causa un cambio conformacional que contrae y cierra estos sitios. Otra estructura muestra que la picrotoxina, que se une al dominio transmembrana, estabiliza el receptor en una conformación de canal cerrado. Sin embargo, una tercera estructura revela que cuando el GABA y la picrotoxina están presentes, uno de los dos sitios de unión al GABA está incompletamente cerrado, lo que indica que la unión a la picrotoxina influye en los sitios de GABA. Curiosamente, las estructuras obtenidas cuando el GABA y una benzodiacepina están presentes indican que estos compuestos refuerzan las interacciones entre las porciones extracelulares, por lo demás débilmente asociadas, de las subunidades α y γ. Esto podría explicar cómo las benzodiacepinas promueven la actividad del receptor cuando el GABA está presente.
En teoría, la participación de combinaciones específicas de subtipos de receptores GABAA en procesos normales y de enfermedad en particular, es prometedora para intervenciones farmacológicas precisas. En la práctica, el gran número de diferentes subunidades de GABAA (19 subunidades) que tienen secuencias de aminoácidos sustancialmente similares hace que la selección de medicamentos específicos para cada subunidad sea tediosa, si no imposible. Los datos estructurales detallados que se presentan en los dos documentos que aquí se examinan, así como una mejor comprensión de la gran diversidad del dominio intracelular, probablemente proporcionarán un marco sólido para el diseño de fármacos guiado por la estructura y abrirán nuevas vías para la investigación sobre el descubrimiento de fármacos.
Fuente bibliográfica
An in-depth structural view of a GABAA brain receptor
Michaela Jansen
Department of Cell Physiology and Molecular Biophysics, Center for Membrane Protein Research, School of Medicine, Texas Tech University Health Sciences Center, Lubbock, Texas 79430, USA.
DOI: 10.1038/d41586-018-07843-7