Telómeros y hematopoyesis clonal
Una reciente publicación describe la asociación entre mutaciones de la línea germinal en POT1 (gen que codifica la proteína protectora de los telómeros) y el desarrollo de hematopoyesis clonal.
Esta condición representa la expansión clonal de una célula madre hematopoyética (HSC) y su progenie, impulsada por mutaciones somáticas en genes "controladores", como DNMT3A, TET2 o JAK2, y se le conoce como hematopoyesis clonal de potencial indeterminado (CHIP) cuando la frecuencia del alelo variante en el ADN sanguíneo es del 2% o superior. Se ha demostrado que algunas mutaciones de POT1 previenen el acortamiento progresivo del ADN telomérico que normalmente ocurre con cada división celular y que está asociado con cánceres como la leucemia linfocítica crónica, el melanoma, y el angiosarcoma. El descubrimiento de que están fuertemente vinculados a CHIP sugiere un efecto fundamental sobre los telómeros.
Los telómeros, del griego fin (telos) y parte (meros), son estructuras ubicadas en los extremos de la mayoría de los cromosomas eucariotas, compuestos por secuencias repetitivas de ADN (TTAGGG) que se asocian físicamente con shelterina, un complejo proteico que incluye a POT1 (figura 1). Estas proteínas tienen funciones clave para frenar la degradación del ADN cromosómico terminal y evitar que los sistemas de reparación del ADN identifiquen erróneamente las puntas de los extremos cromosómicos como roturas de doble cadena.
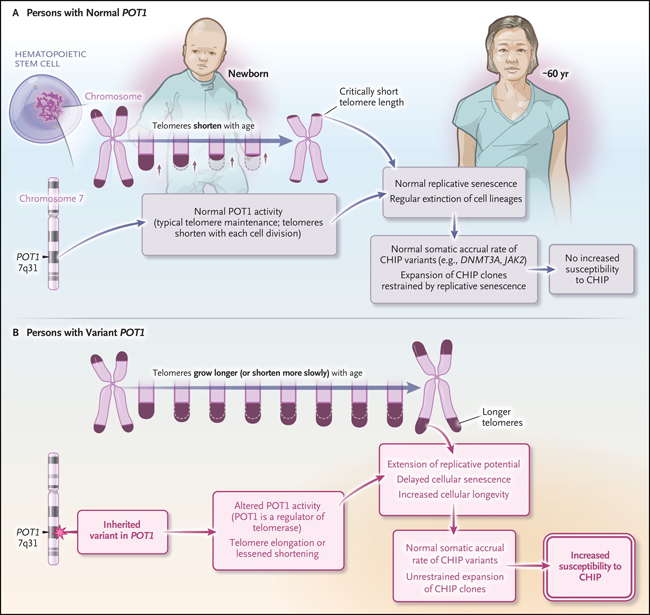
Figura 1: POT1, longitud de los telómeros y hematopoyesis clonal de potencial indeterminado.
Durante la división celular, la maquinaria de replicación del ADN genera una copia de cada cromosoma, pero no puede copiar el final de cada telómero, un concepto conocido como “el problema de la replicación final”. Esta falla resulta en la pérdida de 50 a 100 pares de bases de ADN telomérico con cada división celular. Con procesos sucesivos, los telómeros se acortan y finalmente alcanzan un umbral crítico, desencadenando una respuesta al daño del ADN e induciendo la senescencia replicativa, lo que evita más divisiones celulares.
En células germinales y cancerosas, el acortamiento progresivo de los telómeros es contrarrestado por la acción de la telomerasa, una transcriptasa inversa especializada que agrega secuencias repetidas de telómeros al final de ellos. Las células madre de los tejidos proliferativos, como la piel y la sangre, también pueden expresar telomerasa, lo que les permite dividir y replicar su ADN varias veces. La telomerasa es un complejo de ribonucleoproteínas compuesto por una transcriptasa inversa (TERT), ARN de telomerasa (TR o TERC) y la proteína disquerina (DKC1). TERT tiene una estructura similar a una manopla que le permite rodear cada extremo cromosómico y agregar repeticiones de telómeros monocatenarios, utilizando TERC como plantilla. En los mamíferos, el reclutamiento de telomerasa a los telómeros está mediado por un heterodímero formado por las proteínas POT1 y TPP1.
Las mutaciones patogénicas en los genes que codifican las proteínas del complejo de la telomerasa provocan telómeros más cortos y un grupo de enfermedades conocidas como síndromes de telómeros cortos. El trastorno prototipo es la disqueratosis congénita, que se caracteriza por pigmentación de la piel, distrofia ungueal, leucoplasia oral, encanecimiento prematuro del cabello, fibrosis pulmonar e insuficiencia de la médula ósea. En contraste con las alteraciones genéticas observadas en los síndromes de telómeros cortos, ciertas mutaciones de la línea germinal que afectan a POT1 están asociadas con telómeros inusualmente largos. Curiosamente, las variantes somáticas de POT1 también pueden aumentar la longitud de los telómeros y se han identificado en HSC de personas con síndromes de telómeros cortos; aquí, la variante POT1 "rescata" el desgaste de los telómeros y facilita la supervivencia y la expansión clonal de las HSC mutantes.
Se desconoce el mecanismo a través del cual las mutaciones de POT1 alargan los telómeros. Sin embargo, los estudios de asociación de todo el genoma han revelado que los telómeros más largos están relacionados con polimorfismos en muchos genes vinculados con los telómeros, incluidos TERT, TERC y POT1, aunque en un grado más sutil que la asociación entre los telómeros más largos y las mutaciones de POT1 descritas en la investigación. Es posible que la variante POT1 conduzca a telómeros más largos al aumentar la estabilidad o actividad de la telomerasa o al mejorar su reclutamiento en los telómeros.
La capacidad de la variante POT1 para detener o desacelerar el desgaste de los telómeros permite que las células con POT1 mutante experimenten muchas más divisiones celulares que las con POT1 normal. Las unidades que se dividen con frecuencia, como las células inmunitarias o las células madre de los tejidos proliferativos, son las que más se benefician de este atributo. Su capacidad para evadir la senescencia replicativa y continuar dividiéndose puede verse como una forma de longevidad o juventud prolongada, a nivel de linaje celular. Emily A. DeBoy, Mary Armanios y colegas (DOI: 10.1056/NEJMoa2300503) encontraron que los portadores de la mutación POT1 tenían un retraso en el envejecimiento del cabello, lo que puede reflejar la longevidad de los melanocitos, contrario al envejecimiento prematuro que se observa en los trastornos similares a la disqueratosis.
Para que CHIP sea detectable, una sola HSC necesita generar un clon muy grande de células. Lo hace dividiéndose con más frecuencia que sus pares HSC. Intuitivamente, los telómeros más largos serían beneficiosos para un clon en expansión. De hecho, un gran estudio genético ha sugerido el vínculo causal entre la longitud de los telómeros y CHIP. Sin embargo, la fuerza de la asociación entre las mutaciones POT1 y CHIP identificada aquí (8 de 12 portadores frente a 2 de 21 no portadores relacionados) obliga a reconsiderar tal relación. Se sugiere que la adquisición de mutaciones impulsoras somáticas puede no ser siempre el factor limitante para el desarrollo de CHIP y que el desgaste de los telómeros asociado con la replicación es un mecanismo importante de restricción de CHIP.
Vale la pena señalar que, a diferencia de las expansiones clonales impulsadas por mutaciones en tejidos sólidos, la hematopoyesis clonal no está restringida anatómicamente y, por lo tanto, es posible que se requiera una mayor cantidad de divisiones celulares para que alcance niveles detectables. Si esto es correcto, el desgaste de los telómeros asociado con la replicación puede ser particularmente relevante para la hematopoyesis clonal, en comparación con otras expansiones clonales benignas. Es de destacar que JAK2 mutado fue un impulsor común de CHIP en portadores de variantes POT1, pero esta forma es relativamente poco frecuente en la población general. Quizás esta mutación se adquiere con más frecuencia de lo que se informa (particularmente en individuos que portan un haplotipo de susceptibilidad a JAK2 [GGCC] específico) y normalmente está limitada por el desgaste de los telómeros.
La extensión del potencial replicativo celular mediante el mantenimiento de telómeros largos prolonga la vida útil de un linaje celular y facilita la adquisición de más mutaciones somáticas. Es probable que este mayor número de mutaciones somáticas sea una razón importante detrás del elevado riesgo de cáncer entre personas con variantes de POT1. Sin embargo, los tipos de cáncer que se desarrollan en este contexto no son aleatorios y es más probable que sean cánceres que surgen de linajes linfoides y melanocíticos. El hallazgo sugiere que el desgaste normal de los telómeros puede ser particularmente importante para evitar el desarrollo de tales cánceres.
Finalmente, los autores proponen un papel clave para el mantenimiento de los telómeros en el desarrollo de la hematopoyesis clonal. Algunas de estas personas tienen un mayor riesgo de sufrir cánceres mieloides, como leucemia mieloide aguda o síndromes mielodisplásicos, lo que aumenta a medida que el clon hematopoyético incrementa de tamaño. Detener esta expansión retrasaría o impediría la progresión leucémica, y se están desarrollando y probando enfoques terapéuticos para este fin. ¿Podría ser efectiva la inhibición de la actividad de la telomerasa en este contexto? El presente estudio lo apoya como un posible enfoque terapéutico.
Fuente bibliográfica
Telomere Length and Clonal Hematopoiesis
George Vassiliou, M.D., Ph.D.
Department of Haematology, University of Cambridge, Cambridge, United Kingdom.
DOI: 10.1056/NEJMe2303022