PARP1: un blanco terapéutico para el párkinson
La acumulación y agregación patológica de una proteína nuclear y sináptica llamada α-sinucleína (α-syn) subyace a la enfermedad de Parkinson (EP). Se desconocen los mecanismos moleculares por los que las α-syn patológicas provocan la neurodegeneración en la EP. Sin embargo, recientes hallazgos muestran que la α-syn conlleva a la generación de poli ADP ribosa (PAR) vía activación de la enzima encargada de producirla: la poli ADP ribosa polimerasa. La formación de PAR, a su vez acelera la acumulación de α-syn, lo cual resulta en una mayor muerte celular. Los niveles de PAR se incrementan en el líquido cefalorraquídeo y en el cerebro de pacientes con EP, lo que sugiere que la activación de PARP juega un papel importante en la patogénesis. Por lo tanto, las estrategias dirigidas a inhibir la activación de PARP1 podrían ser prometedoras como terapia modificadora de la enfermedad para prevenir la pérdida de neuronas dopaminérgicas en el párkinson.
α-sinucleína
La enfermedad de Parkinson es una enfermedad neurodegenerativa común y debilitante relacionada con la edad que está aumentando rápidamente en prevalencia y se espera que afecte a 14 millones de personas en todo el mundo para el año 2040. El trastorno se define patológicamente por la acumulación de una proteína mal plegada, α-sinucleína, y la muerte de neuronas dopaminérgicas en la sustancia negra. A pesar de la extensa investigación, aún quedan preguntas fundamentales sobre los mecanismos que subyacen a la toxicidad de la α-sinucleína y debates sobre el papel de las diferentes formas de transmisión de la sinucleína de célula a célula (similar a un prión), eventos nucleares, y mecanismos de muerte celular. Además, los ensayos clínicos se ven obstaculizados por la falta de biomarcadores, las dificultades para traducir los descubrimientos en sistemas modelo a los seres humanos y el número de pacientes y los recursos intensivos necesarios para realizar ensayos de gran tamaño. La reorientación de medicamentos ha surgido como una estrategia terapéutica prometedora para reducir los costos y las fallas de seguridad asociadas con el desarrollo de nuevos medicamentos.
Kam y sus colegas (DOI: 10.1126/science.aat8407) describieron recientemente un nuevo mecanismo que impulsa la toxicidad de la sinucleína α, así como un potencial biomarcador y un objetivo de "reutilización": poli (adenosina 5′-diphosfato-ribosa) (PAR) y PAR polimerasa 1 (PARP1), respectivamente. PARP1 modifica las proteínas nucleares añadiéndoles unidades de PAR, un proceso conocido como poli ADP-ribosilación. Desde el descubrimiento del papel de esta proteína en la reparación del daño del ADN, se ha encontrado que la PARP1 participa en varios procesos celulares, incluyendo la regulación de la estructura de la cromatina, alteraciones en la maquinaria transcripcional, procesamiento de ARN y parthanatos (muerte celular dependiente de PARP1, una forma de muerte celular programada). PARP1 representa una diana terapéutica atractiva para la readaptación de medicamentos porque los inhibidores han sido aprobados por la Food and Drug Administration para tratar varios tipos de cáncer.
En su estudio reciente, Kam y sus colegas definieron un nuevo papel para la PAR y PARP1 en la toxicidad por α-sinucleína. Usaron un modelo animal relativamente nuevo pero experimentalmente poderoso de la enfermedad de Parkinson y de las sinucleinopatías relacionadas en las que las fibrillas de sinucleína que se forman in vitro (fibrillas preformadas) son inyectadas directamente en el cerebro de ratón. Las fibrillas preformadas siembran la agregación de la sinucleína endógena α y promueven la diseminación de la proteína de forma priónica. Los autores identificaron un bucle de retroalimentación en el que las fibrillas preformadas con α-sinucleína aumentan el daño al ADN mediado por óxido nítrico, lo que a su vez activa la PARP1, generando PAR y causando la muerte celular a través de parthanatos. Además, PAR interactúa directamente con α-sinucleína, acelerando su fibrilación in vitro y promoviendo tanto la toxicidad como su propagación in vivo. Los autores demostraron entonces que la toxicidad se suprime en ratones PARP1 knockout, o mediante la administración de inhibidores de PARP1 u óxido nítrico sintasa. Finalmente, encontraron niveles más altos de PAR en el líquido cefalorraquídeo (LCR) de las personas con enfermedad de Parkinson que en el de las personas no afectadas, lo que aumenta la posibilidad de que la PAR sea un potencial biomarcador.
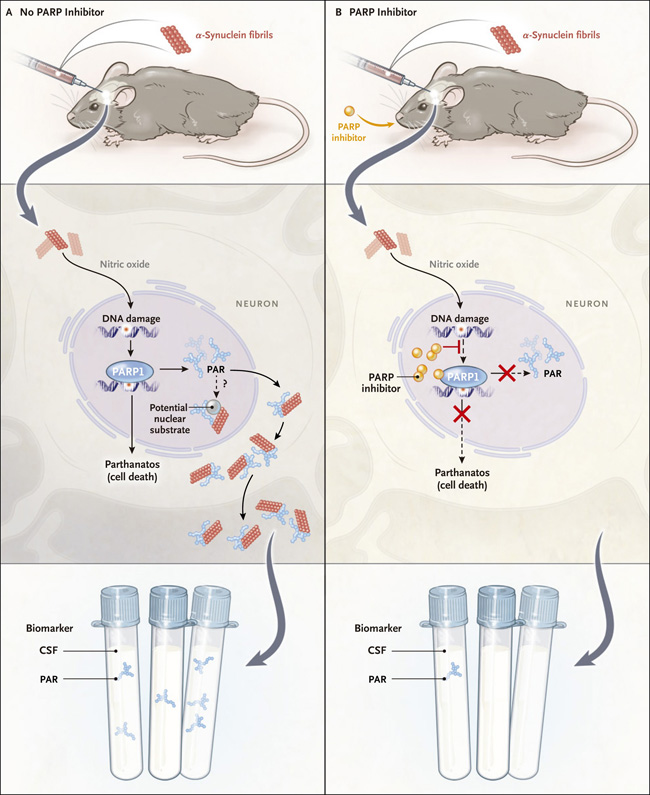
Figura 1. PARP1 como diana terapéutica para las α- sinucleinopatías.
Como se muestra en el Panel A, Kam y colaboradores (DOI: 10.1126/science.aat8407) identificaron un bucle de retroalimentación en el que las fibrillas preformadas de α-sinucleína inyectadas en el cerebro de ratón inducen daño al ADN mediado por óxido nítrico. Esto activa la poli(adenosina 5′-diphosfato ribose) (PAR) polimerasa 1 (PARP1), que genera PAR. A su vez, PAR interactúa directamente con la α-sinucleína para acelerar la fibrilación de la α-sinucleína y la neurotoxicidad en el citoplasma, el espacio extracelular, y posiblemente también en el núcleo con respecto a las inclusiones de sinucleína nuclear fibrilar que se encuentran en la atrofia multisistémica. Los pacientes con la enfermedad de Parkinson tienen un mayor nivel de PAR en líquido cefalorraquídeo (LCR), lo que convierte a la PAR en un biomarcador candidato. En el Panel B, los inhibidores de PARP bloquean la formación de PAR, reduciendo la fibrilación de la sinucleína α, su propagación y la muerte celular relacionada a través de la vía parthanatos. Si la PAR fuera validada como un biomarcador, se predeciría que los inhibidores de la PARP reducirían los niveles de PAR en LCR.
El trabajo actual se cruza con numerosas e interesantes preguntas en el campo de la sinucleína α. Por un lado, existe evidencia creciente en sistemas modelo para apoyar la transmisión de célula a célula de la α-sinucleína, pero esto es intrínsecamente difícil de confirmar en humanos. Debido a que los inhibidores de la PARP1 actúan al menos en parte reduciendo la propagación de α-sinucleína, la eficacia clínica de los inhibidores de la PARP1 en el párkinson podría proporcionar evidencia indirecta que apoye la transmisión de la α-sinucleína en pacientes. Finalmente, hay evidencia emergente de toxicidad nuclear directa de las proteínas agregadas (incluyendo pero no limitado a α-sinucleína) en enfermedades neurodegenerativas. Dada la localización nuclear normal de PARP1, la enzima podría promover la formación de especies de sinucleína nuclear tóxica, ya sea a través de la unión directa de PAR a α-sinucleína o a través de la poliADP-ribosilación de otro sustrato nuclear (figura 1).
El nuevo trabajo de Kam y colegas prioriza la inhibición de PARP1 como blanco terapéutico en la enfermedad de Parkinson y destaca las áreas que requieren mayor investigación. Será necesario un trabajo adicional para validar la PAR en el LCR como biomarcador y evaluar la seguridad de los inhibidores de PAR1 en el contexto de la administración a largo plazo para la enfermedad neurodegenerativa progresiva. La inhibición puede tener relevancia para otras sinucleinopatías distintas a la enfermedad de Parkinson, como la demencia con cuerpos de Lewy y la atrofia multisistémica. La demencia con cuerpos de Lewy impone una mayor carga sobre la enfermedad que el párkinson, y la atrofia multisistémica puede ofrecer ciertas ventajas en términos de ensayos clínicos dada su condición de patología huérfana y la duración esperada potencialmente más corta del tratamiento debido a su naturaleza rápidamente progresiva. El reporte de este estudio ilustra la importancia de los rigurosos esfuerzos de investigación básica a largo plazo para llevar las terapias basadas en mecanismos a la práctica clínica.
Fuente bibliográfica
PARP Inhibitors and Parkinson’s Disease
Abby L. Olsen, M.D., Ph.D., and Mel B. Feany, M.D., Ph.D.
Departments of Neurology and Pathology, Brigham and Women’s Hospital, and Massachusetts General Hospital.
DOI: 10.1056/NEJMcibr1814680