Melanoma: un asunto de piel y edad
El cáncer es una enfermedad relacionada con el envejecimiento. Clínicamente, los pacientes de edad que sufren de esta patología tienden a tener un peor pronóstico que los más jóvenes. Esto puede ser debido a la acumulación de daño celular, a la disminución de la inmunidad adaptativa, y a la inflamación crónica. Sin embargo, los efectos de un entorno celular envejecido sobre la progresión tumoral siguen siendo inexplorados en su gran medida. Dado que los fibroblastos dérmicos pueden tener un profundo impacto en la progresión del melanoma, una reciente investigación examinó si los cambios relacionados con la edad en este tipo celular podrían conducir a una metástasis de melanoma e influir en las respuestas terapéuticas. La relevancia de este estudio es que proporciona una visión integrada de cómo los fibroblastos en un microambiente envejecido, pueden contribuir a la progresión del melanoma, ofreciendo nuevas posibilidades para diseñar terapias para las personas mayores.
Entorno viejo y metástasis
La edad avanzada es un factor de riesgo para el cáncer, y no hay duda que la acumulación de daños en el ADN en el tiempo contribuye a la fuerte correlación existente entre la generación de tumores y el envejecimiento. El aumento en el número de mutaciones oncogénicas en células precancerosas incrementa las probabilidades de la transformación celular (carcinogénesis). Además, los cambios asociados a la edad que se dan en el sistema inmunológico pueden resultar en la disminución de la respuesta adaptativa y en el desarrollo de un microambiente inflamatorio que favorece la tumorogénesis. De esta forma, se promueve su progresión, contribuyendo además a un mal pronóstico en personas mayores.
Aproximadamente el 50% de las personas que reciben un diagnóstico de melanoma son mayores de 65 años de edad, y aunque la activación de mutaciones oncogénicas de susceptibilidad a melanoma (por ejemplo, BRAF V600E), se han relacionado con la edad, no se sabe mucho acerca de los efectos de un microambiente envejecido. Sin embargo, un reciente estudio liderado por Amanpreet Kaur (Nature. 2016 Apr 14;532(7598):250-4) mostró cómo los fibroblastos en un entorno envejecido pueden contribuir al crecimiento y progresión del melanoma.
Normalmente, los melanocitos se producen en la membrana basal de la capa epidermal de la piel, y aunque por lo general no están en contacto directo con los fibroblastos dérmicos, están expuestos a factores secretados por esas células. Durante el envejecimiento, la arquitectura de la piel cambia sustancialmente (figura 1), y el ADN de los fibroblastos, similar al de los melanocitos, aumenta su deterioro, lo cual repercute en la composición de las proteínas que se secretan. Y, con la edad, los fibroblastos tienen una mayor tendencia a entrar en senescencia, un estado donde se produce un arresto o detención proliferativa, fenómeno que es inducido por el estrés celular, asi como también por la erosión de telómeros, daño en el ADN o por la señalización oncogénica.
Kaur y sus colegas abordaron el papel del envejecimiento de un microambiente en el contexto de un melanoma mediante la inyección de células de este tipo de cáncer en un modelo de estudio animal (ratones). La particularidad del material celular administrado es que posee la mutación BRAF V600E, que está implicada en diferentes mecanismos de melanomagénesis. Tras la inyección realizada en ratones jóvenes y en animales viejos, se evidenció que los tumores desarrollados en estos últimos crecieron mucho más lento que aquellos producidos en los jóvenes, pero con un fenotipo mucho más agresivo: los autores observaron una angiogénesis potenciada y un mayor número de metástasis pulmonares (figura 1). Tales observaciones fueron corroboradas mediante modelos tridimensionales de piel humana, que comprende fibroblastos de personas menores a 35 años y de adultos mayores a 55 años en los que los fibroblastos poseen un profundo efecto en proinvasivo sobre las células de melanoma.
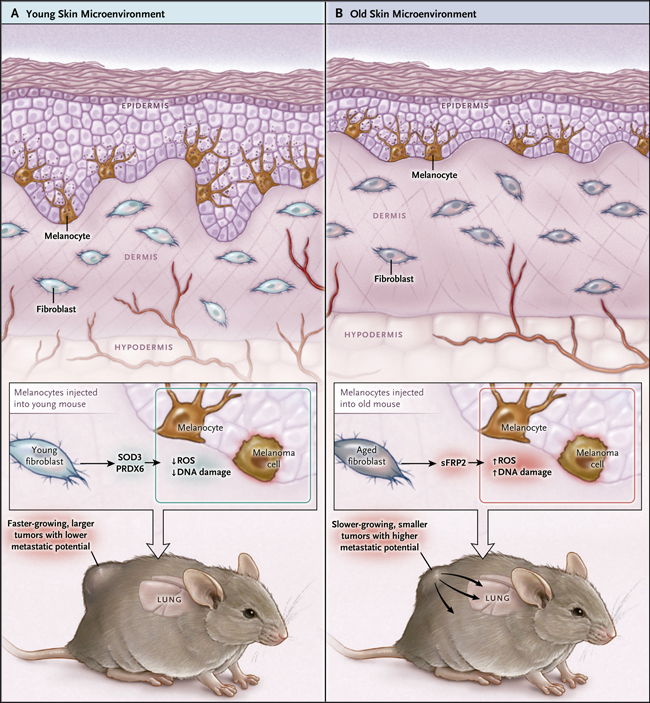
Figura 1. Aumento del potencial metastásico del melanoma inducido por un microambiente viejo.
La piel de las personas de edad muestra las principales alteraciones, incluyendo la degeneración de fibras de colágeno dérmico y el alisamiento de la unión dermis-epidermis. Los fibroblastos aislados de personas jóvenes producen eliminadores de especies reactivas de oxígeno (ROS) como la superóxido dismutasa 3 (SOD3) y peroxirredoxina 6 (PRDX6), pero su expresión es reducida en los fibroblastos de individuos mayores. Bajo condiciones in vitro, estas células (las más nuevas) protegen a los melanocitos (así como a las células tumorales de melanoma) del estrés oxidativo inducido por ROS, mientras que los fibroblastos mayores ven comprometida esta función. Los fibroblastos más viejos también producen la proteína tipo 2 secretada relacionada a frizzled (SFRP2), que incrementa los niveles intracelulares de ROS, lo que a su vez, promueve daño en el ADN. Cuando se inyectan células de melanoma en ratones en un entorno más envejecido, aumentan los niveles de ROS, se induce daño del material genético, las células crecen más lentamente, generándose tumores más pequeños, con una superior capacidad de metástasis que las células que crecen en ratones jóvenes.
Análisis detallados de fibroblastos de personas adultas revelaron propiedades prometastásicas y otras igual de relevantes que interfieren con la eficacia de la terapia contra tumores portadores de la mutación BRAF V600E. Fibroblastos más viejos producen elevadas cantidades de la proteína de secreción tipo 2 relacionada a frizzled (SFRP2), la que se puede detectar en el suero de ratones viejos y que además favorece la angiogénesis tumoral y metástasis pulmonar al ser administrada en ratones jóvenes (en el modelo Braf V600E). Además, estos fibroblastos secretan una menor cantidad de recolectores (scavengers) de especies reactivas de oxígeno reactivo (ROS).
Por lo tanto, parece que las células de melanoma en la proximidad de los fibroblastos de edad avanzada pueden tener un nivel más alto de estrés oxidativo respecto a un entorno de fibroblastos jóvenes. Niveles elevados de sFRP2 pueden disminuir la capacidad de respuesta del melanoma frente al estrés oxidativo. Por lo que en conjunto, la escasez relativa de eliminadores de ROS y la abundancia relativa de sFRP2 representan a un golpe doble para los niveles de estrés oxidativo en las células de melanoma. De hecho, los fibroblastos de ratones más viejos inducen un alto nivel de estrés oxidativo en ese ambiente tumoral, que a su vez da lugar a daños en el ADN. El potenciamiento del estrés oxidativo y del daño al ADN se ha vinculado no solo con un fenotipo tumoral más agresivo sino que también con resistencia a fármacos dirigidos al protooncogen BRAF tales como vemurafenib.
Adicionalmente, los autores encontraron que los injertos de melanoma portadores de la mutación BRAF V600E son menos sensibles a vemurafenib en ratones más viejos.
La relevancia clínica de este estudio es sustentada por datos que muestran niveles séricos de SFRP2 significativamente más altos en pacientes con melanoma, quienes son por lo demás, mayores de 55 años de edad. Por otra parte, las muestras de melanoma de individuos más longevos exhiben menores niveles de los reguladores de la expresión del estrés oxidativo y altas cantidades de marcadores de daño de ADN. Por ende, este hallazgo, debería ser evaluado debido a su relación con la progresión de la enfermedad.
En el contexto de la terapia dirigida a BRAF, los autores probaron si es que la edad se asocia con la respuesta al tratamiento en una pequeña cohorte de pacientes, con la idea de que la tasa de respuesta podría ser menor en pacientes de edad avanzada. Tras establecer una comparación entre aquellos menores y mayores de 65 años, se evidenció, como se esperaba, una notoria diferencia de la respuesta a la terapia.
En resumen, Kaur y sus colegas describen una nueva conexión molecular que involucra la participación de sFRP2, que conecta la edad del paciente con la progresión y la respuesta terapéutica en el melanoma. Tal vez el bloqueo farmacológico de esta proteína podría mejorar los enfoques existentes, como por ejemplo, los inhibidores de BRAF en pacientes mayores. Sin embargo, es incierto si sFRP2 es un biomarcador candidato para la respuesta (o falta de ella) a los inhibidores de BRAF, debido a que la cohorte de pacientes evaluada no era lo suficientemente amplia como para observar asociaciones significativas entre sFRP2 y la respuesta al tratamiento.
Fuente bibliográfica
Melanoma and the Microenvironment — Age Matters
Claudia Wellbrock, Ph.D.
University of Manchester, Manchester, United Kingdom.
DOI: 10.1056/NEJMcibr1606907
Temas Relacionados