Manejo dirigido para la leucemia linfocítica crónica
La leucemia linfocítica crónica (LLC), el tipo más común de leucemia, rara vez se puede curar. Al año, y a nivel mundial, provoca unas 40.000 muertes.
Debido a una mejor comprensión de sus características biológicas, se ha producido una transición en las opciones terapéuticas de la quimioinmunoterapia a los tratamientos dirigidos. Sin embargo, los últimos aún no son curativos. Son costosos, tienen efectos tóxicos específicos y, en última instancia, conducen al desarrollo de clones de células tumorales resistentes. Por lo tanto, los médicos se enfrentan a un número cada vez mayor de pacientes con enfermedad resistente. Este es particularmente el caso en los que se desarrolla resistencia a los inhibidores de la tirosina quinasa de Bruton (BTK), generalmente por la adquisición de una variante somática que cambia el sitio de unión de la proteína.
A pesar de su naturaleza maligna, las células de la LLC conservan la sensibilidad a las señales externas en los ganglios linfáticos: en este sentido, se parecen a las células B maduras y sanas. Numerosas señales del microambiente orquestan de forma conjunta el aumento de la expresión de "proteínas prosupervivencia" y la activación y proliferación de células B malignas. Como tal, el entorno de los tejidos linfoides, como los ganglios linfáticos y el bazo, proporciona un nicho protector para las células de la LLC, y la recirculación de estas entre la sangre y el tejido linfoide, es un componente fundamental de la homeostasis de la condición.
La BTK es una tirosina quinasa no receptora que es un componente de la vía de transducción de señales que media la respuesta de las células B para encontrar su antígeno. Su activación es fundamental para la localización y retención de células B sanas y también de células LLC en los tejidos linfoides. De hecho, al acoplarse el receptor de células B (BCR) en la superficie de la célula LLC, se inicia una cascada de señalización que conduce a cambios en la expresión génica que impulsan la proliferación y supervivencia (figura 1). BTK es un componente aguas abajo de la ruta BCR y tiene un papel fundamental en el mantenimiento de la LLC. Debido a que BTK es crítica solo para las células B, y la pérdida de su función no es letal para el huésped, representa un objetivo terapéutico atractivo dado que su inhibición debe ser específica para la inhibición de células B. La supresión de BTK en la célula LLC no da como resultado la muerte celular inmediata, pero priva a la célula LLC de señales proliferativas y de supervivencia.
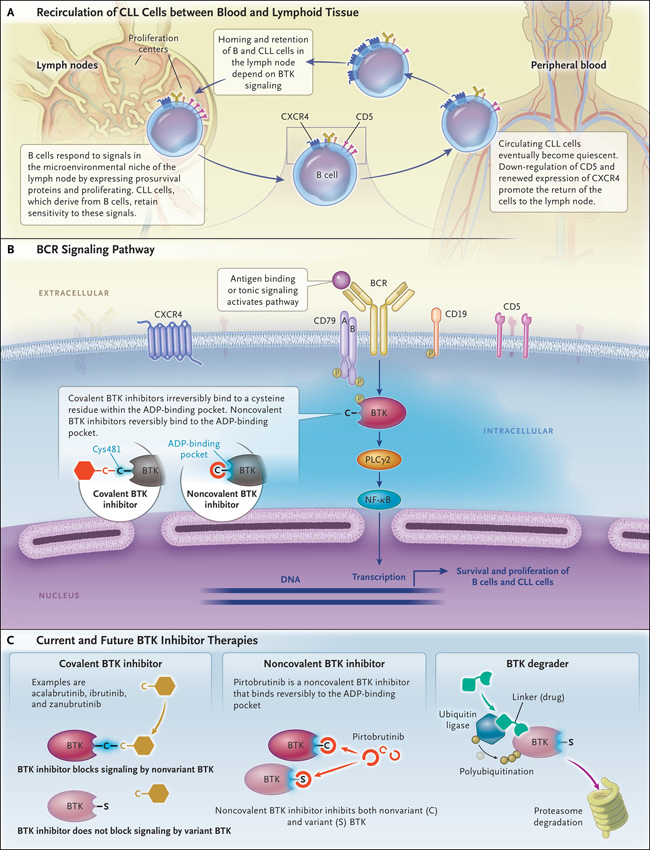
Figura 1: inhibidores de la tirosina quinasa de Bruton en la leucemia linfocítica crónica.
La introducción de inhibidores de BTK de unión covalente (ibrutinib, acalabrutinib, tirabrutinib y zanubrutinib) ha mejorado sustancialmente el tratamiento y el pronóstico de la LLC avanzada. Administrado como un fármaco oral diario, el inhibidor de BTK provoca respuestas clínicas rápidas y mejoras en la calidad de vida, aunque la curación sigue siendo difícil de alcanzar. La respuesta a los inhibidores de BTK se acompaña inicialmente de un incremento en el recuento de linfocitos, reflejando la pérdida de ubicación de las células LLC en los ganglios linfáticos y quizás en otros tejidos linfoides. En pacientes con enfermedad recidivante y fuertemente pretratada, los inhibidores de BTK se asocian con una mediana de supervivencia libre de progresión de 3 a 4 años. Como terapia de primera línea, el tratamiento con un inhibidor de BTK produce remisiones que duran más de 4 años en aproximadamente el 80% de los enfermos.
Sin embargo, un número considerable de ellos que recibe estos agentes interrumpen la terapia debido a los efectos secundarios, que en su mayoría son causados por la inhibición de quinasas distintas a la BTK. Los eventos adversos más comunes que conducen a la interrupción del tratamiento son las arritmias cardíacas, particularmente la fibrilación auricular, y neumonía. Además, del 13 al 37% de los pacientes suspenden estos inhibidores de BTK debido a la pérdida de eficacia y al desarrollo de resistencia. La interrupción de un inhibidor de BTK debido a efectos tóxicos es más común en los que reciben ibrutinib, mientras que la interrupción debido al desarrollo de resistencia ocurre con cualquiera de los inhibidores de BTK.
Todos los inhibidores de BTK aprobados se unen covalentemente al residuo de cisteína (Cys481) dentro del bolsillo de unión de ADP de la proteína BTK, lo que da como resultado la supresión total de su actividad. La unión es irreversible y puede "superarse" solo mediante la generación de nuevas proteínas BTK por parte de la célula. Una consecuencia inevitable de la inhibición continua es el desarrollo de variantes somáticas en BTK que reducen la actividad de estos inhibidores. Las variantes más comunes afectan directamente al residuo de Cys481, que conducen a enlaces reversibles e inestables entre BTK y sus inhibidores. Menos comunes son las variantes de "ganancia de función" adquiridas en el gen que codifica la quinasa posterior PLCγ2 (PLCG2). Estas dan como resultado una señalización de BCR prolongada, ocurriendo solas o en combinación con variantes de BTK.
Los inhibidores de unión no covalentes no requieren Cys481 para unirse. Más bien, se unen a través de hidrógeno, enlaces iónicos e interacciones hidrofóbicas de manera reversible al bolsillo de unión de ADP. Aunque pirtobrutinib es activo en pacientes con variantes de Cys481, se ha demostrado que otras variantes están asociadas con la pérdida de unión de ambas clases de inhibidores (covalente y no covalente), por lo que es posible que la eficacia de los inhibidores no covalentes también se vea limitada por ciertas variantes somáticas que ocurren en BTK.
Se están desarrollando otros inhibidores de BTK no covalentes (p. ej., nemtabrutinib, fenebrutinib y vecabrutinib), pero aún no se ha determinado qué tan bien tratarán los tumores con mutaciones de resistencia (aparte de Cys481). Una nueva clase de fármacos que conduce a la destrucción de la proteína BTK se está evaluando en ensayos clínicos. Estos degradadores de BTK inducen la degradación proteasómica de las proteínas BTK y parecen funcionar bien contra la LLC independientemente del estado de la variante.
La terapia de combinación por tiempo limitado es otro enfoque. La idea es evitar la resistencia que surge en respuesta a la exposición prolongada al fármaco. Los resultados respaldan la seguridad de pirtobrutinib, por lo que es un candidato para nuevas terapias combinadas para tratar la leucemia linfocítica crónica. Los inhibidores de BTK, como el pirtobrutinib, también podrían combinarse con anticuerpos biespecíficos contra las células T, un enfoque que debería superar la disfunción adquirida de las células T ocurrida en la LLC y que dificulta las terapias dirigidas a las células T.
Fuente bibliográfica
Inhibiting BTK in Chronic Lymphocytic Leukemia
Arnon P. Kater, M.D., Ph.D., and Barbara Eichhorst, M.D.
Department of Hematology, Cancer Center Amsterdam, Amsterdam University Medical Centers, University of Amsterdam, Amsterdam (A.P.K.); and Department I of Internal Medicine and Center for Integrated Oncology Aachen, Bonn, Cologne, Düsseldorf, University of Cologne, Cologne, Germany (B.E.).
N Engl J Med 2023; 389:83-86