Fuerza activadora de linfocitos T
El receptor de células T (TCR), es el principal determinante del desarrollo y activación de los linfocitos T y de las respuestas inmunitarias a antígenos extraños. El mecanismo de ensamblaje de este complejo proteico sigue siendo desconocido. Sin embargo, gracias a las avanzadas técnicas de microscopía crioelectrónica, recientemente se ha reportado la estructura detallada de TCR humanos en complejo con el hexámero CD3 a una resolución de 3.7 Å, y lo que es más relevante, se ha determinado cómo las fuerzas biomecánicas de unión ligando receptor modulan la activación del TCR. Estos datos revelan la base estructural del ensamblaje del complejo TCR-CD3, y proporciona detalles valiosos para determinar cómo se activa una célula T, lo que a su vez se podría traducir en una base para el diseño racional de futuras inmunoterapias utilizando este complejo proteico.
TCR como mecanosensor
Los receptores de células T (TCR) reconocen células disfuncionales que expresan fragmentos de proteínas anormales. Tales anormalidades pueden surgir en las células si, por ejemplo, se desarrolla cáncer o se produce una infección. Cuando los TCR reconocen estos péptidos inusuales, los receptores se activan y estimulan a los linfocitos T a destruir o inhibir las células anormales. Tales respuestas están siendo utilizadas para terapias clínicas contra el cáncer. Los TCR también son de interés porque su disfunción puede conducir a enfermedades de autoinmunidad o inmunodeficiencia.
En un reciente estudio publicado en Nature, Dong y colaboradores presentan la estructura de un TCR humano, a una resolución de 3,7 ångströms, obtenida usando una técnica de imagenología llamada microscopía electrónica criogénica de una sola partícula (cryoEM). Esta estructura de alta resolución de todo el TCR no existía anteriormente, y proporciona una gran cantidad de detalles sobre este receptor (Nature. 2019 Sep;573(7775):546-552).
Durante más de 35 años, se ha sabido que cada TCR del tipo llamado αβTCR es un complejo proteico. Ocho proteínas lo conforman: seis de ellas se conocen colectivamente como CD3, que actúa en capacidad de señalización cuando se activa un TCR. CD3 comprende un heterodímero de CD3ε y CD3δ (CD3εδ), un heterodímero de CD3ε y CD3γ (CD3εγ) y un homodímero de CD3ζ (CD3ζζ). Las otras dos proteínas que forman el TCR son TCRα y TCRβ, que crean el heterodímero de unión de ligandos (TCRαβ) que reconoce un péptido ligado al complejo mayor de histocompatibilidad (MHC) en la superficie de otra célula - una combinación llamada pMHC. TCRα, TCRβ, CD3δ, CD3ε y CD3γ contienen regiones extracelulares (llamadas ectodominios), regiones péptidas de conexión, regiones transmembranas y colas citoplasmáticas.
Las numerosas células T de cada persona tienen el mismo conjunto de proteínas CD3, pero TCRα y TCRβ tienen lo que se llama dominios variables que difieren entre las células T, de modo que las diferentes células T tienen una capacidad única para reconocer péptidos específicos - llamados antígenos - en los pMHC. Ya se sabe mucho sobre la estructura y función de los componentes individuales del TCR, pero la comprensión de la estructura completa del TCR promete proporcionar nuevas perspectivas.
Dong y sus colegas coexpresaron todas las proteínas TCR en células de cultivo, donde se ensambló el complejo TCR. Los autores aislaron el complejo y lo estabilizaron para crioEM por reticulación química, para formar enlaces permanentes entre proteínas adyacentes. Este enfoque le permitió a los autores obtener datos estructurales. Dada la limitada superficie de interacción entre los distintos dímeros CD3 y los ectodominios TCRαβ mostrados por Dong y sus colegas, es posible que existan conformaciones TCR alternativas. La reticulación utilizada para obtener datos criogénicos impone restricciones a la variabilidad estructural.
Los dominios variables apareados formados por el heterodímero TCRαβ están situados en el centro del TCR, en la región extracelular más alejada de la membrana celular (figura 1). La superficie de los dominios variables para unir un pMHC está orientada de forma coherente con la idea emergente de que el TCR actúa de forma selectiva en la dirección como mecanosensor durante el reconocimiento de antígenos. Se une su ligando en una sola dirección, debido a una propiedad física llamada anisotropía.
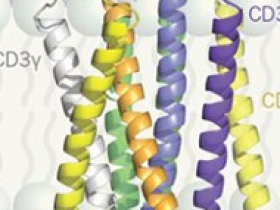
Figura 1. Receptor de células T.
Dong y colaboradores reportan una estructura del receptor de células T humano (TCR). Este receptor orquesta las respuestas de defensa inmunológica cuando reconoce péptidos anormales. El TCR contiene ocho proteínas: una TCRα (morado claro), una TCRβ (naranja), dos CD3ε (amarillo), un CD3γ (blanco), un CD3δ (morado oscuro) y dos CD3ζ (verde). TCRα y TCRβ tienen cada uno un dominio variable con lazos de unión (cian y magenta, respectivamente) que reconocen un complejo de un péptido unido a un complejo mayor de histocompatibilidad (no mostrado), llamado pMHC. Si un TCR se une a un pMHC que reconoce, la transmisión forzada en tal interacción sintoniza su sensibilidad y especificidad, y por lo tanto el TCR actúa como un mecanosensor. El TCR une los pMHC de una manera selectiva en cuanto a la dirección en el lugar indicado por la flecha. El lazo FG (rojo) de la región constante de TCRβ probablemente transmite fuerza desde la región extracelular del TCR a través de la membrana hacia el interior de la célula T para propiciar la activación de la célula T y una respuesta defensiva. Los autores no obtuvieron datos estructurales para las colas citoplasmáticas de las proteínas del TCR.
Otra característica estructural destacable del TCR es la amalgama de los ectodominios, que consisten en lo que se denomina los dominios constantes de TCRα y TCRβ, así como los ectodominios de CD3εγ y CD3εδ, además de los segmentos extracelulares cortos de CD3ζζ. Los péptidos conectan los ectodominios y el conjunto de ocho hélices transmembrana, una hélice por cada proteína del TCR. En la estructura de Dong y colaboradores, las hélices transmembrana se encuentran principalmente en una orientación paralela entre el detergente digitonina que se utiliza para reemplazar el lípido de la membrana celular para la solubilización de proteínas y la obtención de imágenes. Los autores no pudieron obtener información estructural para las colas citoplasmáticas de las proteínas TCR, que incluyen regiones CD3 que son vitales para la señalización durante la activación de las células T. Presumiblemente, esto se debió a que estas regiones tienen una alta flexibilidad de conformación en ausencia de lípidos normales de la membrana celular.
La estructura de Dong y sus colegas es convincente por muchas razones. Los autores acoplaron estructuras de componentes de TCR obtenidos previamente mediante cristalografía de rayos X a su estructura. La ubicación de los ectodominios de CD3εδ y CD3εγ en relación con los de TCRα y TCRβ es coherente con los datos anteriores. Además, en la región transmembrana, la estrecha yuxtaposición de residuos básicos de aminoácidos en el heterodímero TCRαβ y los aminoácidos ácidos en las proteínas CD3 apoyan una propuesta previa de que tales interacciones podrían ayudar a orientar las hélices de la transmembrana.
Un motivo proteínico evolutivamente conservado llamado CxxC, que se encuentra en las regiones de péptidos conectores de CD3εγ y CD3εδ, tiene un papel crucial en la señalización de CD38. Dong y sus colegas reportan conexiones moleculares llamadas puentes disulfuro en cada una de estas cuatro conexiones CxxC de las proteínas, y también describen la arquitectura de las proteínas que rodea estas conexiones clave.
El movimiento dinámico de los segmentos de proteínas TCRα y TCRβ se ha visualizado previamente utilizando resonancia magnética nuclear (RMN). El modelo del TCR como mecanosensor direccional propone que las fuerzas ejercidas por la motilidad de las células T y el movimiento de los componentes de la estructura interna de una célula T (el citoesqueleto) mejoran el reconocimiento de pMHC por parte de una célula T en más de 1.000 veces en relación con el reconocimiento en ausencia de fuerza. En consecuencia, cuando un TCR interactúa con un pMHC que reconoce, se coloca una carga física sobre la unión entre el TCR y el pMHC, lo que paradójicamente resulta en un aumento de la vida útil de la unión y provoca cambios estructurales dinámicos en el heterodímero TCRαβ que aumentan la especificidad y sensibilidad del reconocimiento de antígenos. El reconocimiento de sólo uno o dos pMHC anormales entre los aproximadamente 100.000 pMHC normales de una sola célula es suficiente para activar la activación de las células T6. Por el contrario, las interacciones entre un receptor típico y un ligando no dependen de las fuerzas biomecánicas como una característica de reconocimiento crucial. La estructura de Dong y sus colegas proporciona información sobre cómo el TCR está configurado como un mecanosensor para cumplir con sus requisitos de especificidad y sensibilidad.
La orientación de los dominios variables y el posicionamiento del sitio de unión al antígeno favorecen una interacción direccional del TCR con un pMHC que es consistente con los movimientos de exploración de células T que ocurren tangencialmente a la superficie de la célula estudiada. La estructura de lazo FG5 de la región constante de TCRβ controla la vida útil de un enlace TCR-pMHC y también la extensión del heterodímero de TCRαβ cuando pasa de una forma compacta a una forma extendida bajo fuerza durante el reconocimiento de antígenos. El bucle FG se encuentra encima de CD3ε de CD3εγ. Si el TCR interactuara con un pMHC (derecha en la figura), la fuerza resultante probablemente se transferiría, a través de una geometría como una palanca y un punto de apoyo, desde los dominios variables del heterodímero TCRαβ hacia abajo hacia sus regiones constantes y luego a dímeros CD3 en el mismo plano vertical de abajo. La fuerza probablemente se amplificaría a través de la transición reversible y repetitiva del heterodímero TCRαβ entre sus formas expandida y contraída, que reordena los componentes del TCR.
Los motivos CxxC están situados cerca de la membrana celular, y la rígida conectividad de estas regiones en ectodominios CD3 y la configuración en forma de punta de flecha de los segmentos transmembrana de sus respectivos heterodímeros sugiere que empujar y tirar de los movimientos de TCRαβ a CD3εγ o CD3εδ, o a ambos, podría transferir fuerza a través de la membrana o entregar esta energía como trabajo. Tales fuerzas podrían causar cambios en partes de la estructura del TCR, y afectar a los lípidos vecinos para exponer sitios clave de aminoácidos en las colas citoplasmáticas de CD3. La adición de grupos de fosfato a estos residuos de aminoácidos de tirosina desencadenaría cascadas de señalización y otros cambios celulares necesarios para la activación de las células T. La abundancia de interacciones entre los diversos segmentos de péptidos de conexión del TCR probablemente ayudaría a la señalización.
Cuando los autores superpusieron una estructura disponible de un pMHC unido a un heterodímero TCRαβ sobre su estructura TCR, los heterodímeros de TCRαβ fueron similares en ambas estructuras. Esto no es sorprendente, ya que la aplicación de fuerza es probablemente la causa principal de los cambios estructurales que impulsan los reordenamientos de las subunidades TCR, y estas estructuras se obtuvieron en ausencia de fuerza, y por lo tanto capturan un estado compacto del heterodímero de TCRαβ. El proceso de reconocimiento de TCR-pMHC basado en la fuerza difiere de las interacciones típicas entre receptores y ligandos, como las interacciones entre anticuerpos y antígenos, que son independientes de la fuerza. El aprovechamiento de la energía de los movimientos celulares para el evento mecanosensor podría explicar cómo, a diferencia de las interacciones independientes de la fuerza, los TCR pueden discriminar tan sensiblemente entre antígenos muy similares, que difieren en un solo aminoácido.
Se ha sugerido que los reordenamientos de las subunidades que ocurren cuando se aplica la fuerza al TCR podrían fomentar la disociación del dímero CD3, empezando por CD3ζζ, y que esto contribuye a la activación de las células T. La estructura de los autores confirma que la disociación causaría cambios en la estructura del TCR en la región transmembrana.
El trabajo de Dong y sus colegas proporciona una base para futuros estudios. ¿Podrían obtenerse estructuras de otros TCR de tipo αβ de especificidades de antígenos definidas, con o sin los pMHC correspondientes? ¿Sería posible obtener estructuras de alta resolución de los segmentos transmembrana de un TCR en un entorno natural de membrana lipídica para visualizar las colas citoplasmáticas de las proteínas TCR? ¿Se pueden visualizar las conformaciones del complejo TCR bajo la aplicación de fuerza si se desarrollan nuevos métodos de análisis estructural?
Dada la importancia del TCR para comprender la función de las células inmunitarias y el uso de linfocitos T en la inmunoterapia para abordar el cáncer, la información sobre la estructura de su receptor podría aportar mejoras en el diseño de un TCR con fines terapéuticos. El trabajo de Dong y sus colegas es una llamada urgente a los inmunólogos interesados en la biología tumoral y a otros para que consideren las biofuerzas cuando evalúen las células T in vitro para medir el potencial de sus TCR in vivo. Quedan por delante grandes oportunidades para avanzar más en el desarrollo de TCR de alta calidad para uso clínico.
Fuente bibliográfica
The structure of a T-cell mechanosensor
Ellis L. Reinherz
Department of Medicine, Harvard Medical School, Boston, Massachusetts 02115, USA, and at the Dana-Farber Cancer Institute, Boston, USA.
DOI: 10.1038/d41586-019-02646-w