Ferroptosis de células tumorales
La ferroptosis, un proceso de muerte celular impulsado por el metabolismo y la peroxidación lipídica dependiente de hierro. Ha sido relacionada con enfermedades como el daño isquémico a órganos y el cáncer. La enzima glutatión peroxidasa 4 (GPX4) es un regulador central de este proceso y protege las células neutralizando los peróxidos lipídicos, que son subproductos del metabolismo celular. La inhibición directa de GPX4, o la indirecta por el agotamiento de su sustrato glutatión o los bloques de construcción del glutatión (como la cisteína), puede desencadenar la ferroptosis. Este evento contribuye a la función antitumoral de varios supresores tumorales como p53, BAP1 y fumarasa. Contraintuitivamente, las células cancerosas mesenquimales, que son propensas a la metástasis y a menudo resistentes a diversos tratamientos, son altamente susceptibles a la ferroptosis, la que además puede ser regulada por interacciones intercelulares mediadas por cadherina. En células epiteliales, estas interacciones suprimen la ferroptosis activando la vía de señalización intracelular Hippo o la modulada por proteína merlina. Investigando los procesos de señalización intracelular involucradas en la muerte ferroptótica, junto con el análisis de mutaciones malignas en la señalización, se podría predecir la capacidad de respuesta de células cancerosas frente a futuras terapias inductoras de ferroptosis.
Estrategia antitumoral
A finales del siglo XX, se produjo un aumento en un tipo de cáncer llamado mesotelioma, que es causado por la exposición al asbesto utilizado en materiales de construcción. El mesotelioma a menudo surge décadas después de la exposición, y es responsable de decenas de miles de muertes al año en todo el mundo. Incluso con los tratamientos disponibles actualmente, es inevitablemente fatal. Por lo tanto, existe una necesidad urgente de desarrollar terapias más eficaces para este tipo de cáncer. En un artículo publicado en Nature, Wu y colaboradores informan que las mutaciones en una vía de señalización celular que comúnmente se presenta en el mesotelioma, crea una vulnerabilidad tumoral que podría ser el objetivo para tratar esta enfermedad.
El mesotelioma se origina con mayor frecuencia en el revestimiento de los pulmones, en células que forman la membrana pleural. Las mutaciones que se encuentran frecuentemente en las células del mesotelioma a menudo inactivan las proteínas supresoras de tumores, que funcionan en las vías anticancerosas. Una de las proteínas inactivadas más comunes es la llamada merlina (codificada por el gen NF2), que funciona en la vía de señalización Hippo, altamente conservada a nivel evolutivo. Esta vía se identificó originalmente en la mosca de la fruta Drosophila melanogaster y comprende una cascada de señalización que controla la proliferación celular y el tamaño de los órganos. Si merlina u otra proteína de esta vía, como la LATS2, es inactivada, las proteínas río abajo llamadas YAP y TAZ pueden aumentar la expresión de genes que promueven la formación de tumores. Ciertos cánceres pueden llegar a ser "adictos" a la transcripción mediada por YAP para su supervivencia.
Sin embargo, si merlina, LATS2 y otra proteína llamada LATS1 son funcionales, YAP y TAZ se someten a fosforilación (un grupo fosfato está unido a ellas), lo que modifica las proteínas y bloquea su función al impedir que entren en el núcleo para impulsar la expresión génica. Las mutaciones en los genes que codifican para merlina y LATS2 se seleccionan positivamente durante el desarrollo del tumor, de acuerdo con sus funciones normales como proteínas supresoras del tumor en el mesotelioma.
Wu y sus colegas estudiaron los perfiles de expresión génica de células cancerosas humanas cultivadas in vitro, y mostraron que YAP y TAZ impulsan la expresión de proteínas, como ACSL4, que son necesarias para un tipo de muerte celular llamada ferroptosis. Los autores también descubrieron una conexión entre la capacidad de las células para suprimir la ferroptosis y el contacto célula-célula que depende de la proteína E-cadherina. Los autores informan que la alta expresión de E-cadherina en células humanas del mesotelioma cultivadas in vitro está asociada con la resistencia a la ferroptosis. La cadherina E activa la vía Hippo, y los autores continuaron explorando la relación entre esta vía y la ferroptosis.
La muerte celular que ocurre a través de la ferroptosis depende de la reacción entre el hierro celular y el peróxido de hidrógeno. Durante la ferroptosis, un ácido graso poliinsaturado -un tipo de lípido que se encuentra en la membrana celular- sufre una modificación llamada peroxidación, que provoca un aumento en el nivel de especies reactivas de oxígeno. La ferroptosis a menudo se relaciona con el agotamiento del aminoácido cisteína, que es importado en las células por la proteína SLC7A11. La cisteína proporciona un componente básico para la producción de glutatión, una molécula implicada en una vía que puede combatir la ferroptosis.
El medicamento sorafenib está aprobado para uso clínico. Puede inducir ferroptosis al inhibir SLC7A11. Los autores demuestran que el tratamiento con sorafenib de células humanas del mesotelioma cultivadas que tienen mutaciones en el gen que codifica la merlina hace que las células sufran ferroptosis. Ellos reportan que esta sensibilidad a la ferroptosis depende de la expresión génica mediada por YAP y TAZ (figura 1).
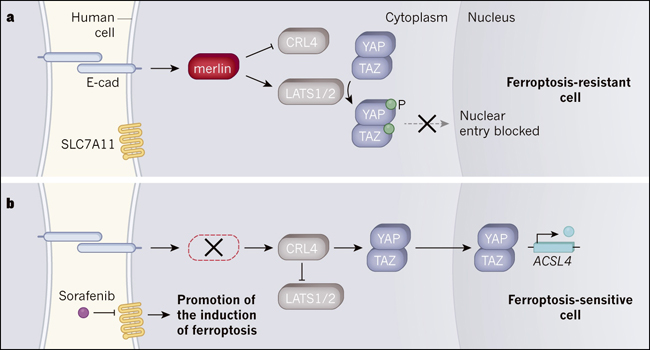
Figura 1. Regulación de la ferroptosis en células humanas.
La ferroptosis es un tipo de muerte celular cuya inducción se ve afectada por una vía que depende de la proteína SLC7A11. Wu y colaboradores investigaron cómo una vía de señalización anticancerosa llamada vía Hippo, en la que las mutaciones ocurren comúnmente en células cancerosas, afecta la ferroptosis. a, Las interacciones entre las proteínas receptoras E-cadherinas (E-cad) en las células adyacentes pueden desencadenar la vía Hippo. Una proteína llamada merlina en esta vía previene la expresión génica que promueve el cáncer al inhibir una proteína llamada CRL4. La inhibición de la CRL4 permite a las proteínas LATS1 y LATS2 añadir un grupo fosfato (P) a las proteínas YAP y TAZ, y esta fosforilación impide que las proteínas entren en el núcleo e impulsar la expresión génica. Los autores reportan que YAP y TAZ impulsan la expresión de genes que promueven la ferroptosis, revelando que la señalización de la vía de Hippo hace que las células sean resistentes a la ferroptosis. b, Si merlina no se expresa debido a una mutación, la CRL4 no se inhibe y LATS1 y LATS2 no pueden funcionar. YAP y TAZ pueden entrar en el núcleo e impulsan la expresión de genes, como ACSL4, que promueven la ferroptosis. Los autores informan que las células tumorales que carecen de merlina pueden sufrir ferroptosis si se tratan con un inhibidor de SLC7A11, llamado sorafenib.
Dos ensayos clínicos independientes encontraron que sorafenib causaba la contracción o estabilización tumoral en personas con mesotelioma. Sin embargo, ninguno de los ensayos evaluó las mutaciones presentes en los tumores de los pacientes, y es tentador especular que aquellos que respondieron particularmente bien tenían mutaciones que inhibían la vía de señalización Hippo y que por lo tanto aumentaban la expresión génica mediada por YAP y TAZ.
¿Podrían otras mutaciones más allá de las de la vía de Hippo también regular la ferroptosis en el mesotelioma? El gen mutado más comúnmente en este cáncer codifica la proteína supresora de tumores BAP1. Esta enzima afecta la expresión génica y puede causar una reducción en la expresión de SLC7A11, lo que, a su vez, conduce a la ferroptosis. Si el gen que codifica la BAP1 está mutado, no se produce ferroptosis. Por lo tanto, la presencia de BAP1 de tipo silvestre podría ayudar a mejorar la ferroptosis, junto con cualquier aumento de la ferroptosis proporcionado por el uso de inhibidores de SLC7A11. No se sabe si los fármacos que inducen ferroptosis, como el sorafenib, serían eficaces en células en que las mutaciones inactivan la BAP1.
Actualmente, se están explorando otros enfoques para tratar el mesotelioma en el que la vía Hippo está inactivada. Por ejemplo, en estudios en animales, la pérdida de la expresión de merlina está asociada con la vulnerabilidad de las células cancerosas a la inhibición de una proteína quinasa de adhesión focal. Sin embargo, no se encontró ningún beneficio con este enfoque en un ensayo clínico. La selección directa de la interacción entre la YAP y la TEAD, una proteína a la que la YAP se une cuando impulsa la expresión génica, es otra estrategia que se persigue para bloquear la expresión génica que promueve el cáncer. Finalmente, YAP y TAZ reclutan la proteína BRD4 para impulsar la expresión de genes específicos, y el uso de un inhibidor de moléculas pequeñas para dirigirse a BRD4 puede interrumpir la expresión génica mediada por YAP y TAZ16. Esta clase de inhibidores de moléculas pequeñas está entrando en los primeros ensayos clínicos. Todos estos enfoques apuntan a bloquear la expresión génica mediada por YAP y TAZ. Sin embargo, si la estrategia anticancerosa que se usa apuntaba a desencadenar la ferroptosis en las células del mesotelioma, entonces se requeriría la expresión génica mediada por YAP y TAZ.
Identificar un tumor que tiene una vía de señalización Hippo inactivada como medio para desarrollar una terapia personalizada contra el cáncer - el objetivo final - plantea algunos retos para el mesotelioma. Centrarse sólo en los tumores que han perdido la función de la merlina probablemente pasaría por alto los mesoteliomas en los que la señalización de Hippo está inhibida por la inactivación de otras proteínas, tales como LATS1 y LATS2. Un estudio previo de la vía de Hippo en varios tipos de cáncer ha revelado que 22 genes son comúnmente transcritos por YAP y TAZ, y este perfil transcripcional podría ofrecer una forma de identificar tumores sensibles a la ferroptosis. Además, debido a que este perfil se encontró en varios tipos de tumores, podría valer la pena explorar la posibilidad de desencadenar ferroptosis para otros tipos de cáncer además del mesotelioma.
El estudio de Wu y sus colegas destaca una estrategia que podría ofrecer una forma de desarrollar una terapia anticancerosa personalizada. Sin embargo, las terapias dirigidas a las mutaciones en el mesotelioma de un individuo están todavía en su infancia. Los ensayos clínicos que toman este enfoque, por ejemplo, el ensayo de terapia estratificada del mesotelioma (ver go.nature.com/2o19lah), podrían ayudar a hacer progresos en tales esfuerzos, y proporcionar tratamientos mejorados en un momento de necesidad clínica insatisfecha.
Fuente bibliográfica
Cancer-cell death ironed out
Dean Fennell
Mesothelioma Research Programme, Leicester Cancer Research Centre, University of Leicester, and at the University Hospitals of Leicester NHS Trust, Leicester LE2 7LX, UK.
DOI: 10.1038/d41586-019-02218-y