Develando el poder antimetastásico del ácido acetilsalicílico
Dosis bajas del fármaco suprimen la vía TXA2-ARHGEF1 en células T, respaldando su efecto contra la metástasis y reafirmando su uso terapéutico en pacientes oncológicos, especialmente aquellos con susceptibilidades genéticas específicas.
Desde hace más de 50 años, se ha reconocido el potencial del ácido acetilsalicílico para influir en la progresión del cáncer. Inicialmente, estudios pioneros en modelos murinos por Gasic y colaboradores sugirieron que la suplementación con este compuesto reducía la incidencia de metástasis pulmonares. A pesar de la evidencia epidemiológica que apoya esta hipótesis, la comprensión mecanicista precisa ha sido un desafío, limitando el diseño e interpretación de ensayos clínicos aleatorizados. Recientemente, un estudio fundamental de Yang y colaboradores ha revelado un mecanismo inmunosupresor previamente no reconocido que clarifica el papel del fármaco, centrándose en la vía del ácido araquidónico y la inactivación de enzimas ciclooxigenasas (COX).
El presente artículo de revisión, realizado por la Dra. Ruth E. Langley de la University College London y el Dr. John Burn de la Newcastle University, en Reino Unido, tuvo como objetivo dilucidar cómo el ácido acetilsalicílico a dosis bajas previene la metástasis, integrando los hallazgos de la investigación básica con sus implicaciones clínicas.
El estudio clave realizado por Yang y colaboradores, se basó en un cribado genético in vivo en ratones para identificar reguladores de la metástasis. Se enfocaron específicamente en la proteína ARHGEF1, cuya disrupción en tejidos del huésped redujo la frecuencia de metástasis. Mediante experimentos genéticos condicionales, se demostró que la pérdida de la función de ARHGEF1 en las células T era crucial para el efecto antimetastásico.
Investigaciones posteriores identificaron al receptor de tromboxano A2 (TXA2), un metabolito de la vía plaquetaria del ácido araquidónico, como un activador de ARHGEF1 en células T. Se utilizaron modelos murinos para evaluar el impacto de un análogo de TXA2 (U46619) y del ácido acetilsalicílico en la modulación de la metástasis. Además, se revisó evidencia de modelos murinos con deficiencia plaquetaria de COX-1 y datos de ensayos clínicos en humanos, como aquellos en pacientes con síndrome de Lynch o cáncer colorrectal con mutaciones PIK3CA.
Los hallazgos de Yang y colaboradores revelan que ARHGEF1, activado por TXA2, es un mediador clave que impide a las células T eliminar las células metastásicas. El ácido acetilsalicílico ejerce su efecto antimetastásico al inhibir esta vía, principalmente mediante la inactivación permanente de la COX-1 en las plaquetas a dosis bajas (75-100 mg/día). Esta supresión de la síntesis de TXA2 por las plaquetas activadas mitiga la progresión tumoral. Se observó que la inhibición de COX-1 plaquetaria reduce la tumorigénesis intestinal y la expresión de COX-2 en adenomas (figura 1).
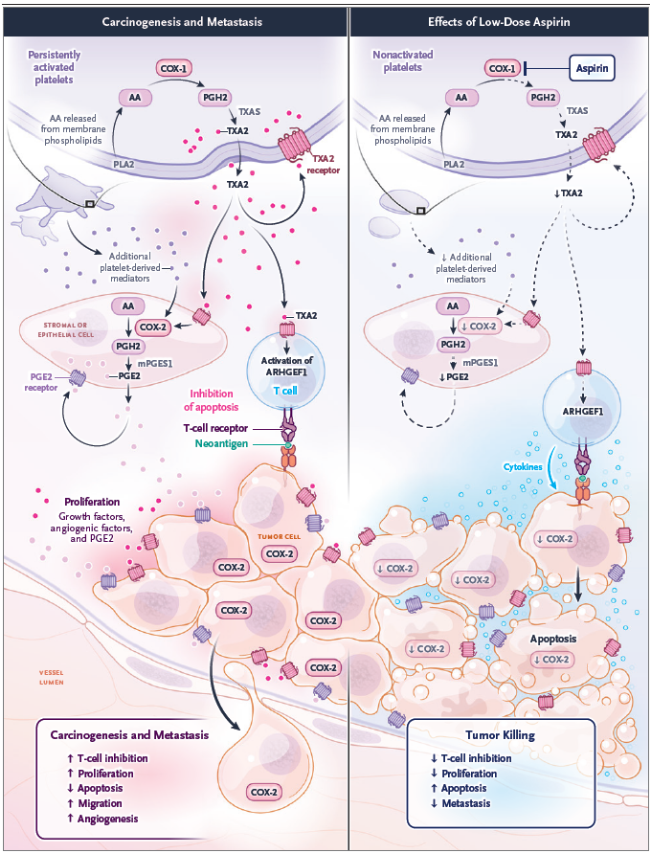
Figura 1. Inhibición de la activación plaquetaria y efectos anticancerígenos del ácido acetilsalicílico
Clínicamente, se ha correlacionado una mejor respuesta al ácido acetilsalicílico en tumores inmunogénicos, como en pacientes con síndrome de Lynch o aquellos con alta expresión de HLA clase I. De manera destacada, pacientes con cáncer colorrectal o rectal con mutaciones PIK3CA se benefician de dosis bajas del ácido acetilsalicílico post-cirugía, sugiriendo un posible efecto inmunomodulador o la generación de neoantígenos específicos por estas alteraciones.
El estudio de Yang y colaboradores establece un vínculo mecanicista claro entre el uso del ácido acetilsalicílico a dosis bajas y la prevención de metástasis mediada por la modulación de la función de las células T. La activación plaquetaria, a través de la vía TXA2-ARHGEF1, emerge como un factor crítico en la inmunosupresión tumoral, y este fármaco contrarresta este efecto. Estos hallazgos validan el reposicionamiento del ácido acetilsalicílico como una herramienta terapéutica con un mecanismo de acción antitumoral y antimetastásico bien definido.
La dilucidación de este mecanismo abre nuevas vías para el reposicionamiento del ácido acetilsalicílico, un fármaco de bajo costo, particularmente relevante en países con recursos limitados. Sugiere la posibilidad de identificar subgrupos de pacientes que podrían beneficiarse de esta terapia basándose en biomarcadores genéticos, como las mutaciones PIK3CA, o inmunes. Aunque la adopción generalizada de este compuesto para la prevención primaria del cáncer y metástasis puede requerir más investigación y pautas claras, este estudio proporciona una base sólida para futuros ensayos clínicos y podría incentivar una mayor aplicación de este fármaco en la oncología.
Fuente bibliográfica
Understanding How Aspirin Prevents Metastasis
Ruth E. Langley, M.B., B.S., Ph.D. and John Burn, M.D.
University College London, London; Newcastle University Translational and Clinical Research Institute, United Kingdom
N Engl J Med 2025; 393:2368-2371
Temas Relacionados