CRISPR-Cas9 desafía al síndrome de Down
Esta tecnología de edición genética permite la eliminación eficaz del cromosoma 21 extra en células con trisomía, abriendo nuevas oportunidades para el desarrollo de intervenciones terapéuticas avanzadas en esta condición.
El síndrome de Down, causado por la trisomía del cromosoma 21 (HSA21), es la anomalía cromosómica viable más frecuente, afectando aproximadamente a 1 de cada 700 recién nacidos. A pesar de los avances en la comprensión de sus características clínicas, genéticas y celulares, las intervenciones terapéuticas dirigidas a la causa fundamental de esta afección siguen siendo limitadas. Los enfoques actuales se centran en el diagnóstico prenatal y preimplantacional, pero existen pocas opciones para eliminar el cromosoma extra de las células trisómicas.
Este estudio, llevado a cabo por investigadores de Japón, se propuso demostrar la viabilidad de la eliminación de cromosomas supernumerarios mediante el uso de CRISPR-Cas9 con especificidad alélica para corregir la trisomía 21 en células humanas. El objetivo era desarrollar un método eficiente para eliminar el cromosoma 21 de células madre pluripotentes inducidas y fibroblastos humanos con la trisomía, restaurando así el cariotipo diploide y mejorando los fenotipos celulares.
Se utilizó un método novedoso de extracción de secuencias diana de CRISPR-Cas9 con especificidad alélica. Este procedimiento, basado en la secuenciación del genoma completo de líneas celulares trisómicas derivadas de fibroblastos de la piel y disómicas inducidas (por deleción de un cromosoma 21), permitió identificar secuencias de reconocimiento de Cas9 específicas para un alelo HSA21 (M2). Se diseñaron y evaluaron diversos sistemas CRISPR-Cas9 con especificidad alélica, utilizando múltiples sitios de corte en el cromosoma diana M2. La supresión temporal de los genes de respuesta al daño del ADN (DDR) se empleó para aumentar la tasa de pérdida cromosómica.
La reparación cromosómica se evaluó mediante hibridación in situ fluorescente (FISH), repeticiones cortas en tándem (STR) y secuenciación de ARN (ARN-seq). Además, se investigaron los efectos de la eliminación cromosómica en células diferenciadas terminalmente.
Los sistemas CRISPR-Cas9 con especificidad alélica indujeron la pérdida del cromosoma 21 extra de manera dependiente del número de sitios de corte (figura 1). La supresión de los genes DDR (POLQ y LIG4) aumentó significativamente la frecuencia de eliminación cromosómica. Estos sistemas mostraron una eficiencia de corrección cromosómica significativamente mayor en comparación con los sistemas no específicos de alelos. La corrección del cariotipo restauró las firmas genéticas y mejoró los fenotipos celulares. Un aspecto importante fue que la eliminación cromosómica fue efectiva en células diferenciadas terminalmente y no en división. El análisis de la secuencia del genoma completo no reveló alteraciones genómicas estructurales significativas.
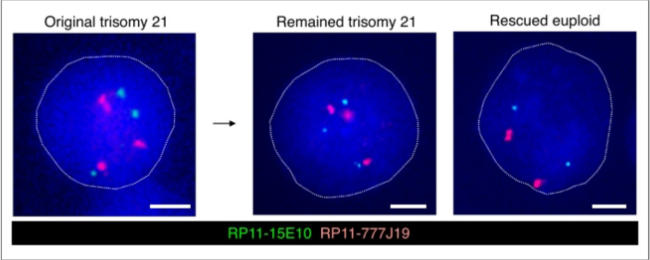
Figura 1: hibridación in situ fluorescente (FISH) mostrando la reducción del cromosoma 21 extra tras el método CRISPR-Cas9 con especificidad alélica.
Esta investigación demuestra la eficacia de la técnica CRISPR-Cas9 con especificidad alélica para la corrección del cariotipo en células trisómicas 21. El enfoque ofrece una ventaja significativa sobre los otros métodos, minimizando el riesgo de deleciones cromosómicas aleatorias. La manipulación de la vía DDR podría mejorar aún más la eficiencia del método. La corrección del cariotipo revierte los cambios en la expresión génica asociados con la trisomía 21.
Estos hallazgos abren nuevas vías para desarrollar intervenciones médicas más sofisticadas para el síndrome de Down. Investigaciones futuras deben centrarse en mejorar la eficiencia de la eliminación cromosómica, desarrollar métodos que no dependan de las roturas de doble cadena del ADN, y optimizar los sistemas de administración in vivo. Es esencial realizar más estudios en modelos y células que sean clínicamente relevantes para evaluar el potencial terapéutico de esta nueva estrategia. Elucidar los mecanismos moleculares subyacentes a los cambios fenotípicos inducidos por la trisomía podría proporcionar información valiosa para el desarrollo de terapias dirigidas.
Fuente bibliográfica
Trisomic rescue via allele-specific multiple chromosome cleavage using CRISPR-Cas9 in trisomy 21 cells
Hashizume R, et al.
Mie University Graduate School of Medicine
https://doi.org/10.1093/pnasnexus/pgaf022