Cofactor enzimático para potenciar la salud
A lo largo de la historia de la vida en la Tierra, ha existido un requerimiento de pequeñas moléculas llamadas nucleótidos. Largas cadenas de nucleótidos forman el código genético, y los nucleótidos individuales transducen señales o transfieren energía. Además, una forma dimérica de nucleótido llamada nicotinamida adenina dinucleótido (NAD+) sirve al menos para dos funciones celulares pivotales. La primera es transportar electrones de alta energía a complejos enzimáticos que se encuentran en las mitocondrias, donde su energía puede ser cosechada eficientemente. La segunda función, es actuar como un sustrato para enzimas como las sirtuinas, que regulan muchos comportamientos celulares. En un reciente estudio se explica un mecanismo fundamental por el cual se mantienen niveles adecuados de NAD+ en la célula, y se demuestra cómo el aumento de esta vía puede modular las enfermedades.
Síntesis de NAD+
La reserva disponible de NAD+ en una célula se rige por el equilibrio entre su generación y su consumo. La vía predominante por la cual se genera NAD+ en roedores depende del reciclaje de una molécula llamada nicotinamida (Nam) que es ingerida o liberada por enzimas que consumen NAD+ (figura 1). Existen varias otras rutas de producción de NAD+, incluyendo una vía de síntesis de novo que comienza con el aminoácido esencial triptófano (Trp). Las mutaciones que interrumpen las enzimas responsables de la conversión de Trp en NAD+ provocan alteraciones del desarrollo multisistémico en humanos, lo que demuestra la importancia de esta vía.
Katsyuba y sus colegas (DOI: 10.1038/s41586-018-0645-6 (2018)) se propusieron estudiar el α-amino-β-carboximuconate-ε-semialdehído (ACMS), un intermediario inestable y poco estudiado de la vía Trp. ACMS puede convertirse espontáneamente al siguiente intermediario en el camino hacia NAD+, o puede ser degradado por un conjunto de enzimas, comenzando con ACMS decarboxilasa (ACMSD). Como tal, se predeciría que ACMSD limitaría la cantidad de NAD+ producido a través de la síntesis de novo. ACMSD es evolutivamente conservada desde el gusano nematodo C. elegans hasta los ratones - una observación que llama la atención porque, hasta hace poco, no se pensaba que los nematodos sintetizaran NAD+ de novo.
Los investigadores inhibieron el gen acsd-1, que codifica el equivalente de ACMSD en nematodos. Esta inhibición aumentó los niveles de NAD+. Se sabe que el aumento de NAD+ prolonga la vida de los gusanos, y los autores encontraron que la vida era mayor en los gusanos en los que la expresión de acsd-1 estaba completamente bloqueada. Además, la prevención de la expresión de acsd-1 dio lugar a respuestas moleculares relacionadas con una menor progresión del envejecimiento; mejor función mitocondrial; y una respuesta protectora al estrés de este organelo.
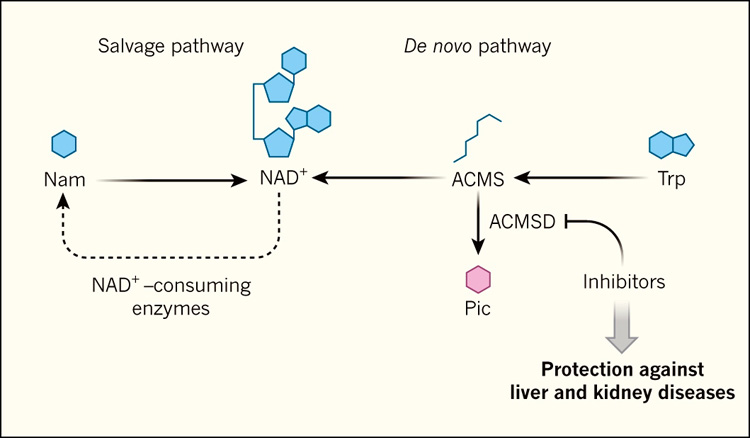
Figura 1. NAD+: biosíntesis en la enfermedad.
Cuando las enzimas consumen la coenzima nicotinamida adenina dinucleótido (NAD+), la nicotinamida (Nam) se genera como producto de reacción. A través de un mecanismo de reciclaje llamado vía de salvamento, el NAD+ puede ser regenerado. El salvamento de Nam se considera el mecanismo predominante para la biosíntesis de NAD+, pero NAD+ también puede generarse a través de múltiples rutas. Una de ellas es la vía de novo, por la cual el aminoácido triptófano (Trp) se convierte a NAD+ a través de varios intermediarios, incluyendo α-amino-β-carboximuconato-ε-semialdehído (ACMS). Esta vía puede ser agotada por la enzima ACMS decarboxilasa (ACMSD), que degrada el ACMS a ácido picolínico (Pic). Katsyuba y colaboradores (DOI: 10.1038/s41586-018-0645-6 (2018)) reportaron que la inhibición química de ACMSD aumenta los niveles de NAD+ en ratones y gusanos nematodos, y mejora los resultados en modelos de ratón de enfermedades hepáticas y renales.
En ratones y humanos, la ACMSD se expresa con mayor fuerza en hígado y riñón, y un estudio reciente indica que estos son los principales órganos de la síntesis NAD+ dependiente de Trp8. Katsyuba y sus colegas encontraron que la inhibición del gen Acmsd aumenta los niveles de NAD+ y la función mitocondrial en células de cultivo provenientes de hígado de ratón. Por lo tanto, los autores desarrollaron inhibidores químicos de ACMSD y probaron si podían mejorar los resultados en modelos de ratón de dos enfermedades relacionadas con el envejecimiento: el hígado graso inducida por la dieta y la insuficiencia renal aguda.
Trabajos previos ya habían descrito un efecto beneficioso de aumentar NAD+ en cada uno de estos contextos. Los datos de Katsyuba y sus colegas confirmaron el potencial para el aumento terapéutico de NAD+. Los tratamientos con sus inhibidores protegieron contra la enfermedad en estos modelos. Los resultados también sugieren que los aumentos en la vía de síntesis de novo NAD+ por sí solos son lo suficientemente robustos como para mejorar las enfermedades hepáticas y renales asociadas con niveles bajos de NAD+. Sin embargo, para demostrarlo será necesario probar que el beneficio de la inhibición de la ACMSD se deriva del aumento de NAD+, y no de otro mecanismo como el agotamiento de la molécula de ácido picolínico, que se produce por la degradación de la ACMSD mediada por la misma ACMSD. Si se probara, este hallazgo sería consistente con un estudio que identificó una enzima diferente en la vía Trp, la quinolinato fosforibosiltransferasa, como un determinante de la susceptibilidad a la insuficiencia renal aguda.
Los inhibidores ACMSD desarrollados por Katsyuba y sus colegas son indicativos del interés en aprovechar el aumento de NAD+ en la clínica. Han pasado casi 20 años desde que se propuso por primera vez que NAD+ fuera un factor determinante para la esperanza de vida. Pero debido a que el envejecimiento es complejo, no se ha encontrado una definición clínicamente comprobable. Los ensayos para examinar la relación entre el aumento de NAD+ y la duración de la vida llevaría demasiado tiempo para ser financieramente viables. Si, en cambio, una definición del envejecimiento incorporara una menor resistencia a los factores estresantes agudos como las infecciones, los traumatismos o la cirugía, entonces las pruebas clínicas de los moduladores de NAD+ podrían ser más viables.
Fuente bibliográfica
A back door to improved health
Samir M. Parikh
Center for Vascular Biology, Department of Medicine and Division of Nephrology, Beth Israel Deaconess Medical Center and Harvard Medical School, Boston, Massachusetts 02215, USA.
DOI: 10.1038/d41586-018-07088-4