Bacterioterapia para la infección por Clostridium difficile
Los tractos gastrointestinales de los mamíferos son colonizados por cientos de especies microbianas que contribuyen a la salud, incluyendo la resistencia a la colonización contra los patógenos intestinales. Muchos antibióticos destruyen las comunidades microbianas del intestino y aumentan la susceptibilidad a patógenos intestinales. Entre estos, Clostridium difficile, una causa importante de diarrea inducida por antibióticos, aumenta en gran medida la morbilidad y mortalidad en pacientes hospitalizados. Aún se desconoce o existe poca información respecto a cómo las bacterias intestinales proporcionan resistencia a la infección por C. difficile y cuáles son sus mecanismos inhibitorios naturales.
Clostridium difficile y microbiota intestinal
El Clostridium difficile es uno de los patógenos más frecuentes en las infecciones nosocomiales en los Estados Unidos y la Unión Europea. Se asocia a una perturbación en la microbiota intestinal; los síntomas van desde diarrea leve a colitis y colitis pseudomembranosa o perforación intestinal. Aunque la mayoría de los casos son tratados con antibióticos (por ejemplo, metronidazol, vancomicina y fidaxomicina), algunos pacientes con múltiples recaídas son tratados a través de la restauración de la flora intestinal. En este enfoque, la materia fecal de un donante es suspendida en solución y se introduce en el intestino del paciente. Este procedimiento tiene variadas etapas, incluyendo el trasplante fecal, sustitución fecal, trasplante de microbiota fecal y una bacterioterapia estéticamente más agradable.
Entender la naturaleza de los cambios en la microbiota durante la infección por C. difficile se ha convertido en un foco importante de investigación. Los estudios han incluido intentos por definir los cambios en la diversidad de las especies y comprender los mecanismos que subyacen a la protección de la microbiota asociada contra la infección. Un reciente estudio de Charlie G. Buffie y colaboradores (Nature 2015; 517:205-8) representa un gran avance en ambos frentes.
Los autores analizaron primero la microbiota intestinal en ratones y seres humanos. La condición sana tiene tres características: gran número de microorganismos (constituyentes), gran cantidad de especies y un aumento de la representación de ciertas líneas bacterianas, como Firmicutes y Bacteroidetes, y una reducida representación de otros tipos, como Proteobacteria. La interrupción de cualquiera de estas características puede resultar en una microbiota intestinal disfuncional, generando mayor susceptibilidad al crecimiento del C. difficile. Cuando las células vegetativas del C. difficile alcanzan un número suficientemente grande durante la infección, se producen dos toxinas principales (A y B) que causan los síntomas intestinales e inflamatorios.
El equipo de Buffie encontró que diferentes clases de antibióticos afectaban a las bacterias del intestino de ratón de varias maneras. Los números reales de células bacterianas eran similares en ratones tratados con antibióticos y en los no tratados, pero la composición de las poblaciones bacterianas diferían. Los investigadores también descubrieron que una alta diversidad en grupos de bacterias no necesariamente se asociaba a la protección contra C. difficile y que una baja diversidad tampoco estaba necesariamente relacionada con la susceptibilidad a su crecimiento.
En pruebas de asociación entre la presencia de ciertas especies bacterianas y la resistencia a la infección, los autores generaron un modelo matemático combinado con datos sobre la composición de la microbiota intestinal en humanos y en ratones mediante la colonización con C. difficile, produciendo las toxinas y síntomas. En algunas especies bacterianas, la relación con la resistencia a la infección se observó sólo en seres humanos; en otros tipos, el vínculo se registró sólo en ratones; y en tres especies de bacterias, la asociación se observó tanto en humanos como en ratones.
La relación entre la infección y una bacteria en particular puede ser el resultado de una predilección de este organismo para un entorno favorecido por C. difficile. Para evitar la causalidad de la asociación, los investigadores seleccionaron cuatro especies bacterianas estrechamente relacionadas con la resistencia a la infección, y probaron cada una individualmente o en combinación su capacidad para prevenir la infección en un modelo de ratón. La combinación de las cuatro especies bacterianas protegió a los animales: el crecimiento de C. difficile era menor, con bajo nivel de toxinas y en donde todos los animales sobrevivieron. La protección proporcionada por una de las cuatro especies, C. scindens, fue sólo ligeramente inferior a la proporcionada por el grupo.
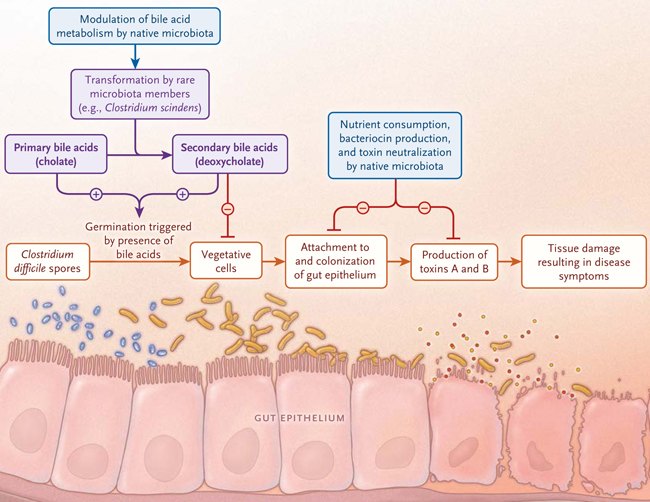
Figura 1: Colonización por Clostridium difficile y microbiota intestinal
La germinación de las esporas es el primer paso de la infección por C. difficile en el intestino de los mamíferos y es dependiente de la combinación de ciertos ácidos biliares (por ejemplo, colato y desoxicolato). Las formas primarias que son producidas por las células humanas se transforman en el intestino a ácidos biliares secundarios por unas pocas especies bacterianas, incluyendo C. scindens. Experimentos in vitro han demostrado que algunos ácidos biliares primarios y secundarios por lo general tienen efectos positivos sobre la germinación de esporas en las células vegetativas, pero compuestos secundarios (por ejemplo, desoxicolato) inhiben el crecimiento de estas. Por lo tanto, la presencia de bacterias intestinales responsables de la síntesis de estos ácidos biliares inhibitorios (por ejemplo, C. scindens) puede reducir el crecimiento de C. difficile. La microbiota intestinal también podría inhibir a las bacterias mediante otros mecanismos, como la competencia por los nutrientes, la producción de bacteriocinas o la neutralización de toxinas.
Por consiguiente, los autores intentaron dilucidar el mecanismo por el cual C. scindens era capaz de proteger contra la infección. Esta bacteria es un microorganismo esporogénico: se ingiere como espora aerotolerante y luego germina en una célula vegetativa estrictamente anaerobia (fig. 1). Posteriormente, coloniza el intestino y produce toxinas a fin de que los síntomas se desarrollen. Los ácidos biliares del intestino sirven como señal para que la espora detecte que ha llegado al tracto intestinal (anaeróbico), en donde germinan. Diferentes ácidos biliares tienen distintos efectos sobre la germinación de las esporas, algunos inhiben y otros estimulan el proceso. Además, los ácidos biliares secundarios también retardan el crecimiento de las células vegetativas. Sólo una pequeña proporción de bacterias intestinales, incluyendo C. scindens, puede convertir combinaciones estimuladoras de ácidos biliares en combinaciones inhibidoras de ácidos biliares; esto parece ser el mecanismo a través del cual C. scindens media la resistencia a la infección por C. difficile en ratones.
¿Hemos llegado al límite de la comprensión de la protección mediada por la microbiota contra C. difficile? Por cierto que no. En primer lugar, la relevancia de los hallazgos en ratones se debe probar en humanos. En segundo lugar, los investigadores observaron que una combinación de cuatro especies diferentes de bacterias proporciona una mejor protección que C. scindens. La combinación de diferentes especies de bacterias con diferentes modos de acción contra C. difficile es probablemente la estrategia más eficaz versus la centrada en una sola especie.
Fuente bibliográfica
Toward a True Bacteriotherapy for Clostridium difficile Infection
Maja Rupnik, Ph.D.
National Laboratory for Health, Environment and Food and the Faculty of Medicine, University of Maribor, Maribor, and the Center of Excellence for Integrated Approaches in Chemistry and Biology of Proteins, Slovenia.
DOI: 10.1056/NEJMcibr1500270