Células iNKT
Terapia en asma y EPOC: prometedora y auténtica
El asma y la enfermedad pulmonar obstructiva crónica (EPOC) afectan a millones de personas en todo el mundo. Estas complejas patologías tienen similares síntomas clínicos con diferentes factores desencadenantes, como el polen en el asma, y el hábito de fumar y los contaminantes industriales en la EPOC. Las infecciones agudas con el virus respiratorio sincitial y el metapneumovirus también generan enfermedades pulmonares crónicas. Estos virus también causan síntomas como los del asma y la EPOC, incluyendo inflamación de las vías respiratorias, hipersecreción de moco y respiración forzada. Durante mucho tiempo ha sido difícil de entender cómo surge esta sintomatología en respuesta a las infecciones virales agudas.
En esta edición, se comenta un nuevo modelo de estudio en ratones que trata de resolver la interrogante. La investigación promueve la conclusión de que operan distintos mecanismos inflamatorios cuando la enfermedad es provocada por la infección, frente a alergenos o contaminantes. Por ejemplo, las denominadas células T asesinas naturales invariantes parecen ser clave en la inducción de la enfermedad. Tras su activación por antígeno, éstas secretan interleuquina-13 (IL-13), que, a su vez, estimulan la activación alternativa de los macrófagos. Los macrófagos producen más IL-13, así como productos que motivan la remodelación crónica de la vía respiratoria.
Infección por virus, asma y enfermedad pulmonar obstructiva crónica
Tanto el asma y como la enfermedad pulmonar obstructiva crónica se caracterizan por una inflamación grave de las vías respiratorias. Esta inflamación se acompaña con un aumento de la producción de moco y una excesiva contracción de la musculatura lisa de las vía aéreas en respuesta a estímulos exógenos, un fenómeno denominado hiperreactividad. Durante mucho tiempo se ha especulado, pero no claramente demostrado, que los virus estarían implicados en el desarrollo de estas enfermedades. Edy Y. Kim y colegas (Nat Med 2008; 14:633-640) acaban de realizar interesantes observaciones respecto a la metaplasia crónica de células caliciformes y la hiperreactividad de los conductos respiratorios en ratones después de la infección por virus.
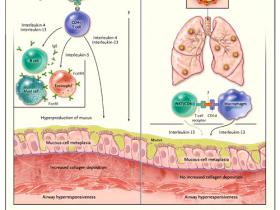
Según el paradigma imperante, los linfocitos T CD4+ del complejo principal de histocompatibilidad o MHC (acrónimo para el inglés major histocompatibility complex) clase II, a través de una respuesta a los alergenos del medio ambiente, son fundamentales para la patogénesis del asma humano (figura 1). Los datos descritos por Kim y colegas han desafiado este concepto. Los autores encontraron que la metaplasia crónica de células caliciformes y la hiperreactividad respiratoria (características típicas del asma y de la EPOC) se desarrollan después de la infección con el virus Sendai. Además, los cambios dependerían en gran medida de la secreción de interleuquina-13 por los macrófagos pulmonares y un subgrupo de linfocitos T CD4-CD8- llamados células T asesinas naturales invariantes (iNKT, por sus siglas en inglés). Los investigadores, por lo tanto, concluyen que la enfermedad crónica de las vías respiratorias puede desarrollarse en ausencia de células T CD8+ clase I del MHC y de células T CD4+ clase II del MHC.
Las células T asesinas naturales invariantes reconocen a las moléculas presentadoras de antígeno denominadas CD1d, altamente conservadas, que se expresan en todo el cuerpo. El término "invariante" deriva del hecho de que todas las células T asesinas naturales invariantes en los seres humanos y ratones utilizan un único receptor de células T que es esencial para la interacción con las CD1d. A diferencia de las moléculas clase I y II del MHC, las cuales presentan antígenos péptidos, las moléculas CD1d presentan antígenos lipídicos contra los linfocitos T, pero los antígenos lipídicos naturales endógenos pueden estimular las iNKT humanas que aún no se han diferenciado. Al utilizar ratones carentes de genes codificadores CD1d o de los elementos estructurales de las iNKT, se encontró que estas células inducen un tipo alternativo de macrófagos, provocando la secreción de interleuquina-13 y, por ende, la generación de metaplasia crónica e hiperreactividad de las vías respiratorias. Estudios previos han indicado la participación de las células T asesinas naturales invariantes en la inducción y mantenimiento de la tolerancia inmunológica; su deficiencia en ratones y seres humanos se ha asociado con la inflamación autoinmune.
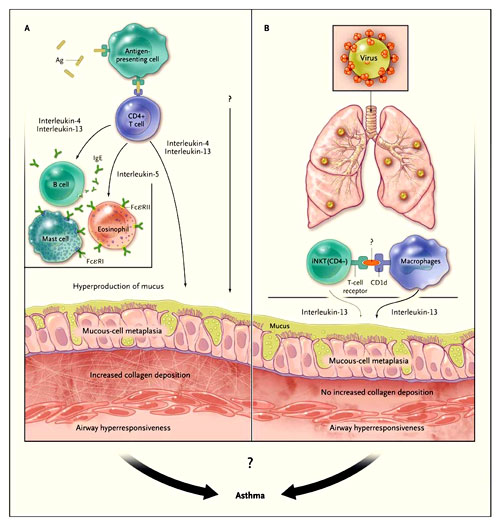
El modelo tradicional (panel A) postula que la patogénesis del asma implica la activación alergeno-específica de las células T por antígeno (Ag) – del complejo principal de histocompatibilidad de clase II - y la posterior producción (por las células T) de células T tipo 2 helper, interleuquina-4, interleuquina-5 e interleuquina-13. Estas unidades actúan sobre las células efectoras inmunes, epitelio bronquial y músculo liso, lo que resulta en la inflamación, la deposición de colágeno, hiperproducción de moco e hiperreactividad de las vías respiratorias. Edy Y. Kim y colaboradores han propuesto recientemente un nuevo modelo (panel B), en la que la infección por virus activa un eje de inmunidad innata que consiste en el reconocimiento de CD1d por iNKT CD4- y la secreción interleuquina-13 a través de macrófagos, lo que se traduce en un metaplasia del epitelio de las vías respiratorias y la hiperreactividad, pero no en la deposición de colágeno.
La idea de que el asma y la EPOC, dos síndromes relativamente distintos (aunque con la superposición de características patológicas), pueden inducirse por un proceso vírico similar, es atractiva, ya que los virus han demostrado estar involucrados fuertemente en las exacerbaciones agudas de los dos trastornos. De confirmarse estos hallazgos, las implicaciones serían muy importantes para la prevención de ambas enfermedades. Sin embargo, el modelo de ratón utilizado por Kim y colaboradores no tuvo en cuenta la asociación clínica y epidemiológica entre la sensibilización por alergenos y el asma, así como la relación entre la exposición al humo del cigarro y la EPOC. El modelo tampoco resulta en el enfisema, una característica clave de la EPOC. Las conclusiones de que la estricta evitación de alergenos perinatales reduce drásticamente la incidencia de atopia y asma, y que la exposición a factores aún no identificados resulta en la protección del asma en los niños criados en granjas, proporcionan un firme apoyo a la idea de que la atopia es necesaria para desarrollar el asma en los pequeños. Aunque la infección con el virus respiratorio sincicial, que provoca bronquiolitis, puede generar la enfermedad crónica de las vías respiratorias, la mayoría de los pacientes (especialmente niños y adultos jóvenes) en los cuales se desarrolla el asma son atópicos. De hecho, hay pruebas que sugieren que la exposición a infecciones virales en la primera infancia protegería contra el asma y la atopia.
El papel de las iNKT en la enfermedad crónica de las vías respiratorias es discutible. Los estudios en ratones han demostrado que in vivo podrían inducir o impedir la hiperreactividad de las vías respiratorias alergeno-inducida. En los seres humanos, algunas investigaciones han observado una acumulación masiva de células T asesinas naturales invariantes CD4+ en pulmones de pacientes asmáticos. Los datos descritos aquí contribuyen al debate. Los autores no sólo identificaron a las células T asesinas naturales invariantes CD4- como actores clave en la hiperreactividad de las vías respiratorias inducida por virus, sino que también observaron que el agotamiento de las células T asesinas naturales invariantes CD4+ no tenían ningún efecto en el modelo utilizado.
Estas discrepancias deben ser consideradas en un debate más amplio acerca de las dificultades en la traducción de las observaciones formuladas a partir de modelos animales para la enfermedad pulmonar. Aunque el prototipo descrito carece del componente inflamatorio observado normalmente en las enfermedades crónicas de las vías respiratorias, se podría especular que la infección vírica sería un evento adicional requerido para la sensibilización atópica hacia el progreso del asma (figura 1). Es igualmente tentador postular que la infección grave del virus determinaría que los fumadores están en mayor riesgo de enfermedades obstructivas de las vías respiratorias, ya que la EPOC se desarrolla sólo en una minoría (15 a 20%) de los fumadores. Los autores proporcionan pruebas de un aumento en el número de linfocitos T Valfa24+ en pacientes con asma y EPOC severa. Por desgracia, su método inmunohistoquímico no fue suficientemente específico para distinguir las células T asesinas naturales invariantes de otras células T con Valfa24 en sus receptores. Si se hubiese utilizado más de un anticuerpo (tales como anticuerpos contra Valfa24 y Vbeta11) o tetrámeros CD1d, la descripción de las células T asesinas naturales invariantes en seres humanos habría sido más precisa e importante para las enfermedades humanas.
¿Cuál es la relevancia de este estudio para el desarrollo de nuevas terapias? A la interleuquina-13 se le considera un objetivo potencial para nuevos tratamientos en pacientes asmáticos, por lo que estos datos añaden más evidencia en apoyo al uso de terapias anti-interleuquina-13. Aunque interferir en el delicado equilibrio entre elementos proinflamatorios y los procesos de regulación puede aumentar el riesgo de inducir autoinmunidad, las células T asesinas naturales invariantes dirigidas a dichas unidades podrían muy bien ser eficaces tanto en el asma como en la EPOC.
Fuente bibliográfica
Virus Infection, Asthma, and Chronic Obstructive Pulmonary Disease
Ratko Djukanovic, M.D., and Stephan D. Gadola, M.D.
Division of Infection, Inflammation and Repair, Southampton General Hospital,
N Engl J Med. 2008 Nov 6;359(19):2062-4