Una espada de doble filo para la diabetes tipo 1
La diabetes mellitus tipo 1 (DM) es una enfermedad multisistémica con consecuencias estructurales bioquímicas y anatómicas. Es una condición crónica que afecta al metabolismo de los hidratos de carbono, la grasa y de las proteínas, causada por la falta de insulina, lo que resulta de una marcada y progresiva incapacidad del páncreas para secretar la hormona debido a la destrucción autoinmune de las células beta. Puede ocurrir a cualquier edad, es más común en los jóvenes, pero también puede desarrollarse en adultos, especialmente entre los 30 y 40 años de edad.
A diferencia de las personas con DM tipo 2, las que padecen diabetes tipo 1 por lo general no son obesas y suelen presentar inicialmente cetoacidosis diabética. La característica distintiva de un paciente con diabetes tipo 1 es que si se retira su insulina, se desarrolla cetosis y eventualmente cetoacidosis. Por lo tanto, estos individuos dependen de insulina exógena de por vida.
Controlar la inflamación de las células beta
La diabetes tipo 1 es una enfermedad autoinmune que conduce a la destrucción de las células beta pancreáticas productoras de insulina y la posterior hiperglucemia. Las permanentes complicaciones de la insulinoterapia a largo plazo tienen un alto costo, en la calidad de vida y en lo económico. La actual epidemia en el mundo occidental (con un aumento de incidencia de 4% anual) ha incrementado los esfuerzos por comprender los mecanismos patogénicos que inducen la destrucción de las células beta y por investigar nuevas estrategias terapéuticas que puedan preservar la masa de células beta y su función.
En la actualidad, estas investigaciones se han beneficiado de un modelo preclínico: el ratón diabético no obeso (NOD), que espontáneamente sufre de diabetes, y que se caracteriza por la presencia de células T y B autorreactivas, capaces de recocer a los antígenos de las células beta pancreáticas. Varios ensayos clínicos adaptados a estos antígenos se han llevado a cabo y algunos están en curso, pero el éxito es limitado. Aunque está claro que las células T de unión a antígeno tienen un papel patogénico, la evidencia también les asigna funciones inmunes innatas. De hecho, los macrófagos, neutrófilos y células dendríticas son unidades críticas en la fase inicial de la enfermedad, a través de su colaboración con las células T autorreactivas anti-islote. Las células dendríticas también influyen en la fase crónica de la diabetes tipo 1 por el mantenimiento de la respuesta inmune autoreactiva contra las células beta del páncreas. Los macrófagos participan en la destrucción de las células beta.
Varios informes han descrito la eficacia de los modificadores epigenéticos en la prevención de respuestas inflamatorias, a través de un efecto sobre los macrófagos. Los modificadores epigenéticos se llaman así porque influencian la expresión génica mediante la deformación de la conformación física de los genes y de los elementos genéticos que los controlan cambiando la secuencia del material genético. Al hacerlo, modifican los elementos reguladores que son críticos para la expresión de genes haciéndolos accesible a otros modificadores, tales como los factores de transcripción.
Algunos modificadores epigenéticos son dependientes de complejas interacciones moleculares que implican a proteínas que contienen un bromodominio, incluyendo la proteína bromodominio y extraterminal (BET); inhibidores de estas proteínas pueden alterar el perfil de expresión génica en una variedad de tipos celulares. La inhibición farmacológica de las proteínas BET ha demostrado tener actividad terapéutica sobre diferentes estados patológicos, en particular en los modelos de cáncer e inflamación.
Un informe de Wenxian Fu y colegas (Elife 2014:3) ha añadido otro estado patológico a esta lista: la diabetes tipo 1. Ellos han probado y demostrado la eficacia del modificador epigenético I-BET151 (inhibidor de una familia de proteínas BET), tanto en la prevención como en la cura de la diabetes en ratones NOD. El tratamiento precoz y tardío con I-BET151 controló la infiltración de leucocitos en los islotes y generó la proliferación de células beta, estimulando y mejorando su función (fig. 1). Aunque el fármaco tuvo poco efecto sobre la expresión génica de las células T infiltradas y en un subconjuntos de células T, afectaba la expresión génica de los macrófagos (sobre todo, la expresión de genes de la vía del factor nuclear kappa B) y alteraba la función de los macrófagos, como se había demostrado anteriormente. Los macrófagos se activan generalmente durante la inflamación; produciendo citocinas y quimiocinas, que a su vez promueven la activación de otras células inmunes. En conjunto, estas células participan en la destrucción de agentes infecciosos o, en el contexto de la diabetes tipo 1, dañando las células beta productoras de insulina. El equipo de Wenxian Fu observó que I-BET151 amortiguaba la función inflamatoria de los macrófagos que infiltran los islotes en ratones NOD. También se registraron cambios consistentes en el perfil de expresión génica de los macrófagos derivados de monocitos humanos expuestos a I-BET151, lo que ha permitido seguir trabajando en la traducción clínica de este tratamiento experimental para la diabetes tipo 1.
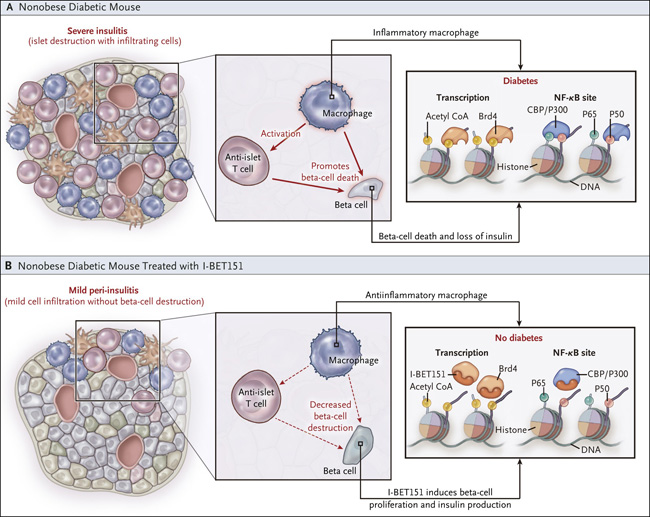
Figura 1: suprimiendo la inflamación y estimulando la proliferación y función de las células beta
La diabetes mellitus dependiente de insulina se desarrolla en ratones diabéticos no obesos debido a una insulitis grave, caracterizada por la presencia de macrófagos y células T inflamatorias anti-islotes. Estos matan a las células beta del páncreas, lo que lleva a la pérdida de insulina y a la hiperglucemia (Grupo A). Un estudio reciente reveló que el uso del modificador epigenético I-BET151 protege los islotes pancreáticos de la insulitis (Grupo B). El número de células inmunes pancreáticas infiltrantes se redujo fuertemente, en comparación con los animales no tratados, y los macrófagos que se encontraban en los islotes tenían propiedades antiinflamatorias y mostraban una disminución en la expresión génica de la vía del factor nuclear kappa B (NF-kB), que conduce a la inflamación. I-BET151 también tuvo un efecto beneficioso sobre la proliferación y función de las células beta. Brd4 denota a la proteína 4 bromodominio.
El I-BET151 no sólo inhibió la respuesta inmune contra las células beta, también aumentó la proliferación y función de las células beta pancreáticas. Varios genes implicados en la regeneración de las células beta, en la diferenciación y producción de insulina, se expresaban a niveles más altos después del tratamiento con I-BET151. Estos resultados fueron especialmente sorprendentes debido a que el gran desafío al tratar la diabetes tipo 1 es restaurar la función de las células beta. Este doble beneficio también hace que sea un atractivo fármaco experimental para la diabetes tipo 2, la que se asocia con inflamación crónica de bajo grado, macrófagos inflamatorios y la producción anómala de insulina por las células beta.
Sin embargo, es posible que I-BET151 interfiera con las modificaciones epigenéticas en todos los tipos de células del cuerpo, dando lugar a efectos secundarios no deseados, tales como la inmunodeficiencia. En relación con esta preocupación, los investigadores realizan la siguiente observación: se necesita un suministro continuo de I-BET151 desde el momento de la aparición de la enfermedad en los ratones NOD para prevenir la recurrencia de la hiperglucemia. Los esfuerzos para definir biomarcadores predictivos, incluyendo la presencia de anticuerpos anti-islotes, podrían permitir al diabetólogo la identificación de personas en riesgo de diabetes tipo 1, lo que potencialmente podría considerarse como tratamiento profiláctico transitorio mediante inhibidores BET.
Fuente bibliográfica
A Double-Edged Sword against Type 1 Diabetes
Agnes Lehuen, Ph.D.
Institut Cochin, INSERM Unité 1016, Hôpital Cochin–Port-Royal, Université Paris Descartes, and Département Hospitalo-Universitaire de Maladies Hormonales et Auto-immunes, Hôpital Cochin, Laboratoire d'Excellence INFLAMEX, Université Sorbonne Paris Cité
N Engl J Med 2015; 372:778-780