Un freno metabólico a la metástasis
Las células cancerosas a menudo reprograman su metabolismo para sustentar la proliferación celular y la supervivencia. Sin embargo, aún se desconoce en gran medida si estas alteraciones metabólicas contribuyen a la migración celular. La UDP-glucosa 6-dehidrogenasa (UGDH) es una enzima clave en la vía del ácido hialurónico que convierte la UDP-glucosa en ácido UDP-glucurónico. Recientemente se ha demostrado que, después de la activación del receptor del factor de crecimiento epidérmico (EGFR), la UGDH se encuentra fosforilada en células de cáncer de pulmón humano. La UGDH fosforilada interactúa con el antígeno Hu R (HuR) y convierte la glucosa UDP en ácido UDP-glucurónico, evento que atenúa la inhibición mediada por UDP-glucosa de la asociación de HuR con el ARNm de SNAIL aumentando la estabilidad del ARNm. El aumento en la producción de la proteína SNAIL inicia la transición epitelio mesénquima, promoviendo así la migración de células tumorales y la metástasis del cáncer de pulmón. Estos hallazgos muestran un papel supresor de tumores para la glucosa UDP en la metástasis del cáncer de pulmón y revela un mecanismo por el cual la UGDH promueve la metástasis tumoral que podría ser blanco para futuras terapias.
Uridina difosfato glucosa
El cáncer se vuelve letal cuando las células tumorales se propagan desde su sitio primario en el cuerpo para invadir órganos distantes - un proceso llamado metástasis. Para que este complejo evento ocurra, las células deben invadir el tejido circundante, entrar en el torrente sanguíneo y colonizar otro lugar, donde se forman tumores secundarios. Varios de los primeros pasos en la metástasis, incluyendo la migración celular, pueden ser inducidos por la activación anormal de un programa de desarrollo llamado transición epitelio-mesénquima (EMT, por sus siglas en inglés), en el cual las células epiteliales que recubren las superficies del cuerpo asumen las características de células mesenquimales, que tienen propiedades migratorias. En un reciente estudio publicado en la revista Nature, Wang y colaboradores identifican un mecanismo previamente desconocido por el cual una molécula generada por el metabolismo celular inhibe la inducción de la EMT y por lo tanto restringe la metástasis del cáncer de pulmón en ratones (DOI: 10.1038/s41586-019-1340-y).
Las moléculas formadas durante el metabolismo pueden tener un papel clave en el apoyo a la supervivencia, proliferación y metástasis de las células tumorales. Las células cancerosas tienen un nivel de absorción de nutrientes superior al normal y vías metabólicas alteradas. Tales propiedades garantizan la síntesis de metabolitos necesarios para el crecimiento tumoral. Cuando estas células anómalas migran al torrente sanguíneo, experimentan estrés celular. Esto se caracteriza por un aumento de especies reactivas de oxígeno. Las alteraciones metabólicas que contrarrestan dicho estrés pueden promover la metástasis, pero si las vías metabólicas afectan a otros aspectos de la metástasis no se comprende en su totalidad.
Para investigar esto más a fondo, Wang y sus colegas bloquearon individualmente la expresión de 111 enzimas en células de cáncer de pulmón humano que habían surgido de células epiteliales. Usando estas células in vitro, los autores encontraron que la inhibición de la síntesis de la enzima UGDH afectaba la capacidad migratoria de las células. La UGDH convierte la UDP-glucosa (UDP-Glc) en ácido UDP-glucurónico (UDP-GlcUA), necesario para producir moléculas de polisacáridos como el ácido hialurónico, un componente de la matriz extracelular en tejidos donde residen las células epiteliales. El ácido hialurónico puede activar receptores en la superficie de las células para iniciar la EMT, y su acumulación en los tumores se asocia a menudo con un mal resultado clínico.
Sorprendentemente, cuando los investigadores inhibieron la expresión de la UGDH, la migración celular no se vio afectada como resultado de la reducción de los niveles de UDP-GlcUA o ácido hialurónico, sino por una acumulación de UDP-Glc. Debido a que la EMT en células cancerosas está asociada con un aumento en su migración, los autores investigaron si UDP-Glc tiene un efecto sobre la inducción de la EMT. Encontraron que el agotamiento de la UGDH, y por lo tanto la acumulación de UDP-Glc, iba acompañado de una disminución en la estabilidad del ARN mensajero que codifica para un factor de transcripción llamado SNAIL. Esta proteína regula la expresión de los genes asociados a la EMT. Cuando los autores diseñaron células cancerosas para que produjeran SNAIL, las células migraron incluso cuando la UGDH se agotó. Estos resultados indican que la UGDH actúa en una vía que regula la migración celular al afectar la producción de SNAIL (figura 1).
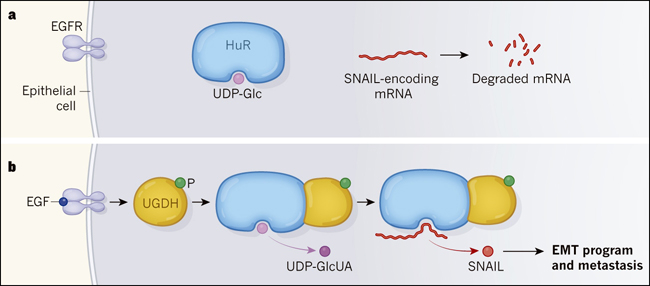
Figura 1. Una molécula formada durante el metabolismo celular impide la migración de las células cancerosas.
Wang y colaboradores (DOI: 10.1038/s41586-019-1340-y) investigaron cómo el metabolismo afecta la migración (metástasis) de las células de cáncer de pulmón humano cultivadas in vitro o trasplantadas en ratones. Estos tumores surgen de células epiteliales. a, En las células epiteliales que expresan el receptor EGFR, la unión de la proteína HuR a una molécula UDP-glucosa (UDP-Glc) impide que HuR se una y estabilice al ARN mensajero que codifica la proteína SNAIL, de modo que este ARNm se degrada. b, Cuando la señalización a través del EGFR es activada por EGF, se añade un grupo de fosfato (P) a la enzima UGDH, lo que permite su inión a HuR. UGDH cataliza la conversión de UDP-Glc a ácido UDP-glucurónico (UDP-GlcUA). Los autores proponen que UGDH lleva a cabo esta conversión en UDP-Glc unido a HuR, permitiendo que HuR se una y estabilice el ARNm de SNAIL. Esto permite producir la proteína respectiva, facilitando un proceso llamado transición epitelio-mesénquima (EMT), que contribuye a la metástasis.
¿Cómo podría una enzima como la UGDH afectar la estabilidad del ARNm? Los autores se centraron en HuR, una proteína que se une y estabiliza ARN mensajeros, incluyendo los transcritos que codifican para SNAIL. Encontraron que UDP-Glc se une directamente a HuR, evitando así que la proteína interactúe con el ARNm que codifica SNAIL. Los autores diseñaron una forma de HuR que tenía mutaciones en residuos de aminoácidos previstos para coordinar su unión a UDP-Glc. En comparación con las células que tenían HuR de tipo silvestre, se encontró que las que tenían la forma mutante eran más propensas tanto a formar metástasis en ratones como a migrar in vitro a través de una membrana en una placa de cultivo.
Esto sugiere que una interacción entre UDP-Glc y HuR previene que HuR actúe en una vía para inducir programas celulares que promuevan la metástasis. Cuando los autores inyectaron células tumorales en ratones y administraron UDP-Glc a algunos de ellos, los que recibieron UDP-Glc tuvieron menos metástasis.
Estos hallazgos podrían tener relevancia para el cáncer humano. En el cáncer de pulmón, el receptor EGFR se encuentra comúnmente activado por mutaciones, y los autores encontraron que un aumento en la señalización a través de este receptor está asociado con una mayor estabilidad del ARNm codificante para SNAIL en células humanas de cáncer de pulmón cultivadas in vitro. Observaron que la activación del EGFR desencadena la fosforilación del residuo de aminoácido tirosina 473 (Y473) en UGDH, induciendo una interacción física entre HuR y UGDH.
Wang y sus colegas especulan que UGDH fosforilada unida a HuR causa la conversión local de UDP-Glc a UDP-GlcUA, mitigando así la inhibición de UDP-Glc de la interacción entre HuR y ARNm que codifica SNAIL y facilitando la acumulación de esta última (figura 1). Los autores crearon células de cáncer de pulmón humano para expresar UGDH que carecía de un residuo de tirosina en la posición 473, y encontraron que dichas células formaban menos metástasis en ratones que las células que tenían UGDH de tipo silvestre. Los autores también señalaron que, en las personas con cáncer de pulmón, la fosforilación de Y473 en UGDH era más común en las metástasis que en los tumores primarios, y que esta fosforilación se asociaba con un mal pronóstico clínico.
Los hallazgos se suman a la creciente evidencia de que los metabolitos pueden afectar los programas de expresión génica. Los ejemplos más conocidos de esto son los casos en que metabolitos proporcionan sustratos para enzimas que regulan la expresión génica modificando grupos químicos unidos al ADN o a las histonas. Sin embargo, UDP-Glc en cambio afecta la expresión génica al prevenir físicamente la interacción entre una proteína y el ARNm. Cómo UDP-Glc afecta específicamente la interacción de HuR con el ARNm codificante de SNAIL, sin perjudicar su interacción con otros mensajeros, es una pregunta abierta. Dados los vínculos entre la expresión de SNAIL, la EMT y la matriz extracelular, es tentador especular que acoplar la producción de SNAIL a los metabolitos que generan ácido hialurónico podría ser una forma eficaz de coordinar los cambios tanto en el metabolismo como en la síntesis de proteínas que se necesitan para promover la metástasis.
Por lo tanto, a diferencia de los metabolitos que se acumulan a través de mutaciones en enzimas asociadas al cáncer y que promueven la progresión tumoral, UDP-Glc limita la progresión. Este descubrimiento amplía nuestros horizontes en cuanto a las formas en que los metabolitos pueden influir en el cáncer. Aunque hace tiempo que se ha reconocido que los perfiles metabólicos de las células cancerosas difieren de los de las células normales, sólo se está empezando a apreciar la complejidad de las alteraciones metabólicas implicadas en el crecimiento tumoral.
Fuente bibliográfica
Metabolic signal curbs cancer-cell migration
Lydia W. S. Finley
Cell Biology Program, Memorial Sloan Kettering Cancer Center, New York, New York 10065, USA.
doi: 10.1038/d41586-019-01934-9