Soltar el control para atacar al cáncer de colon
El bloqueo de los puntos de control inmunológico dirigido al receptor inmunorregulador PD-1 (muerte celular programada 1) o a su ligando PD-L1, y al receptor inmunomodulador CTLA-4 (antígeno 4 asociado a los linfocitos T citotóxicos), ha conseguido importantes resultados clínicos y su aprobación regulatoria como alternativa terapéutica en el melanoma avanzado y en muchos tumores sólidos metastásicos. Sin embargo, muchos pacientes y ciertos tipos de tumores no se han beneficiado de este enfoque. Entre ellos, las personas con cánceres de colon metastásicos, específicamente los que tienen subtipos moleculares asociados con una deficiencia en la reparación por malapareamiento (MMR, del inglés mismatch repair), no han respondido al bloqueo del punto de control. En un reciente artículo publicado en Nature Medicine, Myriam Chalabi y colaboradores reportan una impresionante tasa de respuesta tras un breve tratamiento con el anticuerpo bloqueador de CTLA-4 ipilimumab y el anticuerpo inhibidor de PD-1, nivolumab, en un entorno neoadyuvante antes de la cirugía programada en pacientes operables sin tratamiento.
Inmunoterapia neoadyuvante
Tanto el bloqueo de PD-1 o PD-L1 como el de CTLA-4 activa a las células T atenuando las señales inhibidoras que restringen la inmunidad antitumoral. El PD-1 actúa normalmente inhibiendo la señalización de los receptores de linfocitos T en las células efectoras, lo que desencadena la función antitumoral, mientras que el CTLA-4 atenúa la coestimulación a través del coreceptor CD28, que potencia la activación de las células T en los ganglios linfáticos durante la fase de cebado. También ha surgido recientemente un papel para el bloqueo de PD-1 en la coestimulación de las células T CD28 en este proceso. Una respuesta eficaz al bloqueo de PD-1 requiere la presencia de linfocitos infiltrantes de tumor (TIL) preexistentes en los tumores objetivo, y se ha correlacionado con la presencia de TIL de PD-1hi CD8+ antes de la terapia. Se ha informado de una movilización temprana de células T en la sangre periférica de pacientes que responden al bloqueo de los puntos de control, y tanto en ratones como en seres humanos, la respuesta al bloqueo de PD-1 se ha vinculado a una expansión significativa de los linfocitos precursores de memoria específica del tumor y los linfocitos efectores CD8+7,8. Se cree que el principal determinante de la respuesta al bloqueo de los puntos de control inmunológico es el reconocimiento de neoantígenos tumorales derivados de alteraciones genéticas somáticas, que pueden ser el resultado de mecanismos de reparación genética ineficientes, y la falta de respuesta al bloqueo de los puntos de control inmunológico se predice mediante la "desertificación inmunológica" impulsada por mecanismos intrínsecos al tumor. Se cree que la presencia o ausencia de la MMR repercute en la respuesta a la inmunoterapia, ya que en los tumores con deficiencia de MMR se produce una acumulación de inserciones y/o supresiones y, por lo tanto, de neoantígenos que generan un fenotipo inmunogénico que crea una vulnerabilidad inmunológica.
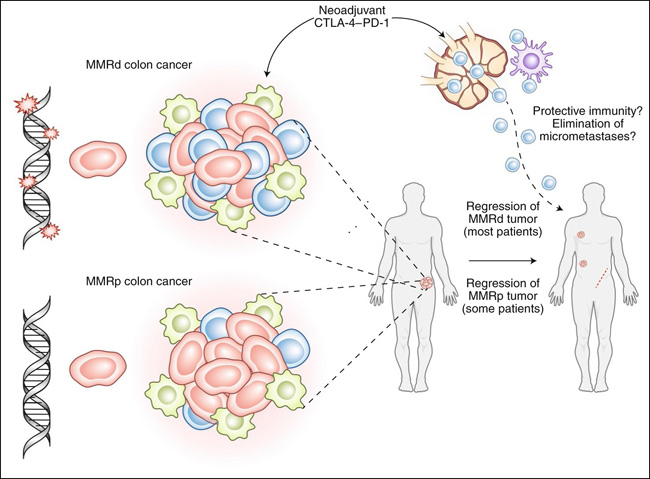
Fig. 1: Bloqueo neoadyuvante de CTLA-4-PD-1 en el cáncer de colon.
Los tumores con deficiencia de MMR (MMRd) (arriba) tienen muchas inserciones y supresiones que generan una plétora de neoepítopes; esto impulsa una considerable inmunorreactividad inicial, caracterizada por una infiltración sustancial de células T CD8+. Los tumores competentes en MMR (MMp, del inglés mismatch repair-proficient) (abajo) son menos inmunorreactivos en estado estable. La administración de una dosis única de ipilimumab y dos dosis de nivolumab provocó una respuesta completa o casi completa en el 80% de los pacientes con deficiencia de MMR y el 20% de los pacientes con MMRp. Se genera la movilización de células T circulantes con la capacidad de reconocer el tumor autólogo, lo que sienta las bases de una inmunidad protectora que también podría eliminar las micrometástasis en estos pacientes.
Cada vez más, la inmunoterapia neoadyuvante, en la que se administra la inmunoterapia antes de la cirugía, está mostrando éxito en varios tipos de tumores. Un beneficio anticipado es la generación de inmunidad protectora, que puede suprimir y eliminar las micrometástasis después de la cirugía; esto puede permitir una mayor remisión a largo plazo y tasas de curación en estos pacientes. En apoyo de esto, estudios en ratones han demostrado que el bloqueo combinado de puntos de control genera una mejor inmunidad protectora cuando se administra en presencia de la masa tumoral primaria que cuando se administra después de la extirpación quirúrgica del tumor primario. Además, el bloqueo de PD-1 y CTLA-4 en el marco de una pequeña carga tumoral puede conducir a la eliminación clonal de células T específicas del tumor debido a la hiperactivación, lo que sugiere que la inmunoterapia neoadyuvante de punto de control es el enfoque preferido para los tumores resecables de etapa temprana.
Chalabi y sus colegas trataron a 40 pacientes con cáncer de colon en fase inicial en un entorno neoadyuvante con ipilimumab y nivolumab. Entre ellos, 20 tenían cáncer de colon con deficienca de MMR, y muchos también recibieron celecoxib, un inhibidor oral de la prostaglandina PGE2, para atenuar la supresión de los TIL por la PGE2. Cabe destacar que el tratamiento fue bien tolerado, y todos los pacientes se sometieron a una resección quirúrgica radical y a una anastomosis intestinal primaria, según lo previsto. Entre los 20 pacientes con tumores deficientes de MMR resecados, el 90% tuvo una eliminación completa (60%) o casi completa (30%) del tumor tras un examen patológico. Notablemente, el 20% de los pacientes con tumores competentes en MMR también mostraron una respuesta patológica completa o importante, mientras que otro 30% tenía evidencia de una respuesta tumoral patológica <50%. Los autores encontraron que todos los pacientes con respuesta patológica tenían signos de inflamación, necrosis y fibrosis en el sitio del tumor. Tanto en los tumores competentes en MMR como en los con deficiencia, hubo una importante movilización de la inmunidad antitumoral. En consonancia con un potente despertar inmunológico en los tumores deficientes para la MMR después del tratamiento, los autores encontraron aumentos en el total de LTI de CD3+, LTI de CD8+ y LTI de CD8+ de PD-1+, así como en las estructuras linfoides terciarias (un sello distintivo de la reacción inmunológica del tumor) en estos tumores deficientes para MMR resecados, y la expresión asociada de la quimiocina CXCL13 y la citoquina IFN-γ. Los autores también encontraron un aumento concomitante en la clonalidad de TIL y un aumento en el número de macrófagos CD68+ después del tratamiento en los tumores con deficiencia de MMR. También detectaron clones de células T circulantes movilizados por el tratamiento que coincidían con los recién detectados en los tumores después de la terapia. Cabe destacar que los linfocitos de la sangre periférica recolectados al final del tratamiento reconocieron organoides tumorales autólogos establecidos de estos pacientes en tres de los seis respondedores (incluido un tumor con capacidad de resonancia magnética nuclear) pero en ninguno de los seis no respondedores.
El estudio de Chalabi y sus colegas constituye un avance potencialmente importante en el tratamiento del cáncer de colon. Los autores descubrieron que la eficacia del bloqueo de PD-1-CTLA-4 era considerablemente mayor en los pacientes que no habían recibido tratamiento y a los que se les había diagnosticado recientemente un tumor de colon resecable versus las respuestas a esos tratamientos en aquellos con cáncer de colon metastásico que se habían sometido a quimioterapia previa. Diversos mecanismos podrían explicar esas diferencias. El proceso metastásico, así como la evolución del tumor mediante la presión de la quimioterapia, puede promover la aparición de exclusión inmunológica o fenotipos "desérticos" en los tumores, lo que explicaría las respuestas más modestas de los pacientes con tumores avanzados. Además, las exposiciones repetidas a la quimioterapia pueden cambiar tanto el microambiente del tumor, estableciendo poblaciones inmunosupresoras de mieloides y estroma, como la inmunidad sistémica y antitumoral, por ejemplo, mediante cambios en el microbioma intestinal y/o el estado nutricional del paciente.
Las respuestas patológicas sin precedentes reportadas en este estudio, especialmente en tumores con deficiencia de reparación por mal apareamiento, abre nuevas oportunidades para el tratamiento de pacientes previamente inoperables, así como el potencial de modificar las prácticas quirúrgicas hacia resecciones menos radicales. Los presentes hallazgos también plantean una serie de importantes cuestiones biológicas y clínicas. ¿Puede la terapia neoadyuvante generar una inmunidad protectora a largo plazo que se traduzca en remisiones duraderas? ¿Cuál es la mejor manera de generar esa inmunidad protectora? ¿Qué enfoque adyuvante posterior, si lo hubiera, debería utilizarse para los pacientes con cáncer de colon que logren una respuesta patológica completa o casi completa, o para aquellos con evidencia de respuesta biológica, pero sin respuesta clínica, o sin respuesta biológica? ¿Cómo se pueden evaluar mejor las respuestas patológicas y biológicas para tales decisiones clínicas? Por último, sigue siendo una interrogante abierta si la inmunoterapia neoadyuvante de punto de control puede aportar beneficios similares a los pacientes con cáncer de colon metastásico que se someten a cirugía o en otros tipos de tumores. Es evidente que el estudio de Chalabi y sus colegas ofrece importantes datos piloto de seguridad y eficacia para un enfoque del cáncer de colon potencialmente seguro y modificador de paradigma.
Fuente bibliográfica
How to Discover Antiviral Drugs Quickly
Jerry M. Parks, Ph.D., and Jeremy C. Smith, Ph.D.
Department of Biochemistry and Cellular and Molecular Biology, University of Tennessee, Knoxville (J.C.S.).
NEJMcibr2007042
Temas Relacionados