Nanocuerpos para la Covid-19
Se requieren nuevas y eficaces terapias contra el SARS-CoV-2. ¿Podrían los nanocuerpos representar una opción en el conjunto de estrategias terapéuticas para tratar la enfermedad por coronavirus?
Muchos esperaban que los fármacos de anticuerpos monoclonales representaran un importante freno a la pandemia la Covid-19, limitando la gravedad de la enfermedad y, por tanto, el número de hospitalizaciones hasta que se pudieran aprobar vacunas seguras y eficaces.
A pesar de la autorización de uso de emergencia emitida por la Administración de Alimentos y Medicamentos (FDA) para los medicamentos de anticuerpos sobre la base de su capacidad para reducir la viremia en pacientes leves y moderados con Covid-19, solo se ha utilizado una pequeña proporción del suministro. Entre los múltiples retos están la ventana terapéutica (estos fármacos son más eficaces cuando se administran durante los primeros 4 a 7 días del curso de la enfermedad), el gran número de pacientes durante una oleada pandémica y la relativa escasez de centros de infusión y de profesionales del personal médico, y la aparición de mutaciones que afectan a la proteína spike, que podrían dar lugar a un aumento de transmisibilidad y al potencial de resistencia a la neutralización por los anticuerpos. Por lo tanto, son muy deseables nuevos esquemas que sean eficaces contra las variantes y ofrezcan una alternativa a los anticuerpos terapéuticos administrados por vía intravenosa.
Por eso es oportuno el estudio de Koenig y colegas sobre anticuerpos de dominio único (o nanocuerpos) derivados de camélidos. Los investigadores inmunizaron a alpacas y llamas con la proteína spike del síndrome respiratorio agudo severo 2 (SARS-CoV-2, por su sigla en inglés) e identificaron nanocuerpos que se unen específicamente al dominio de unión al receptor del virus. Caracterizaron cuatro nanocuerpos neutralizantes (etiquetados como E, U, V y W) de forma estructural y funcionalmente con múltiples ensayos in vitro. Tres de los nanocuerpos (U, V y W) reconocen un epítopo común situado cerca del eje triple de spike trimérica de prefusión, mientras que el nanocuerpo E reconoce el bucle extendido (residuos R466 a P491) que se superpone al dominio de unión al receptor (figura 1C). Los nanocuerpos se unieron al dominio de unión al receptor del virus con una constante de disociación de equilibrio de entre 2 y 22 nmol y neutralizaron la infección por SARS-CoV-2 en un 50% en un ensayo de reducción de placas a concentraciones que oscilaban entre 48 y 185 nmol, resultados similares a los obtenidos con anticuerpos monoclonales.
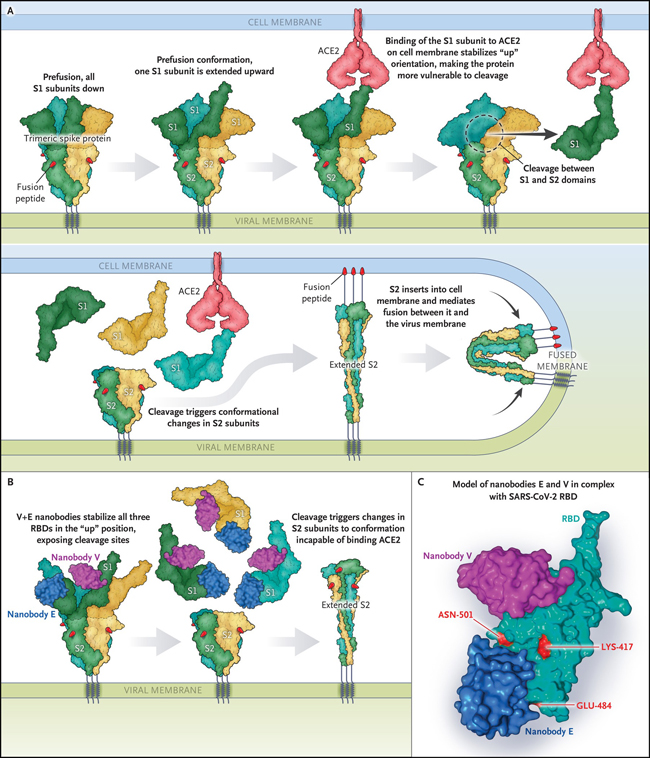
Figura 1: proceso de fusión de la membrana del SARS-CoV-2 y huellas de los nanocuerpos V y E.
La proteína spike del coronavirus del síndrome respiratorio agudo severo 2 (SARS-CoV-2) está formada por la subunidad 1 (S1) y la subunidad 2 (S2). Los trímeros se expresan en la superficie del virus (panel A). En la conformación de prefusión, una subunidad S1 se extiende hacia arriba. La unión de la subunidad S1 a la enzima convertidora de angiotensina 2 (ACE2) en la membrana celular estabiliza la orientación "arriba", lo que probablemente induce la escisión proteolítica. La escisión desencadena cambios conformacionales en las subunidades S2. Esta reconformación implica la extensión del péptido de fusión en la membrana de la célula huésped, con lo que S2 une la membrana de la célula huésped y la membrana viral. Koenig y colaboradores informaron recientemente que los nanocuerpos V+E estabilizan los tres RBD en la posición "arriba". Esta estabilización probablemente permite la escisión proteolítica y la transición estructural prematura, sin llevar a la fusión de la membrana (Panel B). Los nanocuerpos V y E se muestran en complejo con el RBD del SARS-CoV-2 (códigos del Banco de Datos de Proteínas 7KSG y 7KN6) (Panel C). Los residuos modificados en las variantes B.1.1.7 y B.1.135 (K417, E484 y N501) están coloreados en rojo. La puntuación media de la red para los epítopos V y E del nanocuerpo es de 0,344 y 0,326, respectivamente. La puntuación media de la red para el epítopo estructural ACE2, que se solapa con la huella de E, es de 0,325. La puntuación de la red es una medida de las restricciones estructurales de un residuo resultantes de las interacciones interatómicas; las puntuaciones más altas indican más restricciones, y las más bajas indican una mayor susceptibilidad a sufrir mutaciones.
En contraste con el nanocuerpo V, los E, U y W tienen el potencial de impedir que el SARS-CoV-2 se una a la enzima convertidora de la angiotensina 2 (ACE2) en las células del huésped, de acuerdo con la localización de los epítopos a los que se unen y su modo de compromiso con el dominio de unión al receptor. Los nanocuerpos neutralizan el virus induciendo una transición estructural prematura de una conformación de prefusión a una conformación irreversible de postfusión, incapaz de unirse a la ACE2 y, por tanto, incapaz de desencadenar la fusión de membranas.
A continuación, los autores crearon nanocuerpos biparatópicos (es decir, moléculas que tienen dos sitios de unión al antígeno en una sola molécula) mediante la fusión de nanocuerpos dirigidos a distintas regiones epitópicas (por ejemplo, E+V, V+E, E+W y W+E).
Por medio de microscopía crioelectrónica, demostraron que el nanocuerpo biparatópico más potente (V+E) se une a las tres proteínas spike del trímero (estequiometría de nanocuerpo a trímero, 1:3) con todos los dominios de unión al receptor en la conformación "arriba", lo que indica que la unión de los nanocuerpos estabiliza el dominio de unión al receptor y evita el movimiento arriba-abajo, contribuyendo muy probablemente a la escisión proteolítica de spike y a la transición prematura a una conformación irreversible postfusión. El nanocuerpo biparatópico V+E neutralizó la infección por el SARS-CoV-2 a una dilución 62 veces mayor que la alcanzada por los nanocuerpos individuales, posiblemente debido a la mayor avidez por la proteína de spike (una afinidad que es al menos 22 veces mayor que la de los nanocuerpos individuales).
Al pasar un virus quimérico en células Vero E6 en presencia de los nanocuerpos E, U, V y W, pero no en presencia de los nanocuerpos biparatópicos (V+E o E+V), los autores encontraron variantes de escape que tenían mutaciones dentro de las regiones epitópicas. Esta observación pone de manifiesto la ventaja de dirigirse simultáneamente a más de un epítopo vulnerable. La huella del V no incluye los aminoácidos 417, 484 y 501 de la proteína de spike (figura 1C), que están modificados en las cepas recientemente identificadas en Gran Bretaña, Sudáfrica y Brasil, lo que sugiere que el anticuerpo biparatopo V+E (o E+V) sería eficaz contra estas variantes antigénicas.
El epítopo reconocido por el nanocuerpo V es relativamente más restringido que el epítopo E (que incluye los residuos E484 y N501), lo que significa que es menos probable que tolere cambios causados por mutación. Por lo tanto, las mutaciones que surgen en la parte del gen S que codifica esta región (es decir la región de spike a la que se une el nanocuerpo V ) tienen menos probabilidades de sobrevivir a la selección.
Koenig y colaboradores han contribuido al creciente número de estudios que han aislado nanocuerpos contra el SARS-CoV-2. Debido al tamaño relativamente pequeño de los nanocuerpos, tienen propiedades biofísicas favorables y son más baratos de producir mutación. Por lo tanto, las mutaciones que surgen en la parte del gen parte del gen S que codifica esta región (es decir la región de la espiga a la que se une el nanocuerpo V ) tienen menos probabilidades de sobrevivir a la selección.
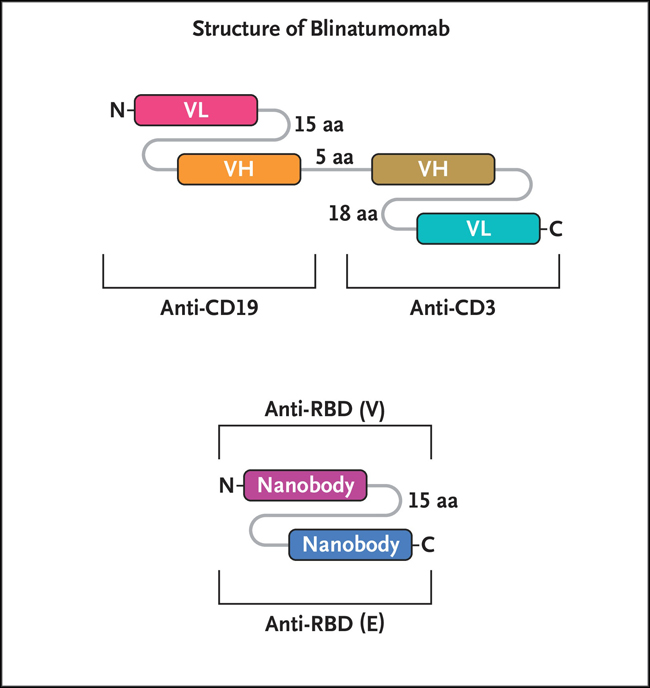
Figura 2: organización modular del blinatumomab biespecífico y de un nanocuerpo biparatópico contra SARS-CoV-2.
Se muestra la organización del blinatumomab biespecífico (diagrama superior) y del nanocuerpo biparatópico V+E del SARS-CoV-2 (diagrama inferior). En el blinatumomab, el fragmento variable de cadena única del anticuerpo anti-CD19 está unido al fragmento variable de cadena única del anticuerpo anti-CD3 por un enlace corto de cinco aminoácidos (diagrama superior). La estructura de los nanocuerpos biparatópicos SARS-CoV-2 es similar a la de un fragmento variable de cadena única: está formada por los dos anticuerpos de dominio único (cadena pesada) de camélidos (es decir, dos nanocuerpos) unidos por un enlazador de 15 aminoácidos (diagrama inferior). Ambos anticuerpos carecen de la región Fc cristalizable. VH significa variable pesada y VL variable ligera.
Koenig y colaboradores han contribuido al creciente número de estudios que han aislado nanocuerpos contra el SARS-CoV-2. Debido al tamaño relativamente pequeño de los nanocuerpos, estos tienen propiedades biofísicas favorables y son más baratos de producir que los anticuerpos monoclonales estándar. Su pequeño tamaño y sus largas regiones determinantes de la complementariedad de la cadena pesada les permiten dirigirse a epítopos cóncavos como el sitio de unión al receptor de la proteína de spike. Los nanocuerpos pueden fabricarse con el uso de sistemas de expresión procarióticos (por ejemplo, a partir de bacterias o levaduras) porque carecen del dominio Fc que alberga el glicano, lo que facilita su fabricación en comparación con los anticuerpos monoclonales estándar. La ausencia de una región Fc elimina el riesgo de potenciación de la infección dependiente del anticuerpo, pero también acorta la vida media, lo que podría solucionarse mediante la unión o amalgama con polietilenglicol o albúmina de suero humano. Además, los nanocuerpos pueden nebulizarse y administrarse directamente a los pulmones de un paciente con Covid-19, lo que supone una mejor alternativa logística a los anticuerpos administrados por vía intravenosa. La formulación en aerosol de los nanocuerpos ha mostrado resultados no clínicos prometedores.
Aunque los nanocuerpos se están investigando para su uso en una amplia gama de enfermedades, desde el cáncer hasta las enfermedades infecciosas, fue la aprobación del caplacizumab (un nanocuerpo bivalente contra el factor von Willebrand) por la Agencia Europea del Medicamento y la FDA para el tratamiento de la púrpura trombocitopénica trombótica y la trombosis lo que marcó la incursión de los nanocuerpos en la medicina clínica. El formato del nanocuerpo biparatópico V+E diseñado por Koenig y su equipo, aunque distinto de un nanocuerpo convencional, es similar al del anticuerpo biespecífico de cadena única y fragmento variable aprobado por la FDA de una sola cadena y basado en fragmentos variables (figura 2). En conjunto, los datos estructurales y clínicos disponibles sugieren que el anticuerpo biparatópico podría ofrecer potencialmente una mejor alternativa a los anticuerpos monoclonales convencionales para el tratamiento de la Covid-19. Recientemente, expertos que representan a varias organizaciones, entre ellas organismos reguladores, el mundo académico y empresas farmacéuticas y biotecnológicas han hecho un llamado para desarrollar fármacos de moléculas pequeñas que inhiban la maquinaria que el virus utiliza para replicarse. Estos agentes son cómodos de administrar e insensibles a las mutaciones virales. El anticuerpo biparatópico, cuando se formule para su administración en aerosol o por vía subcutánea, aportará esas ventajas con la misma eficacia.
Fuente bibliográfica
Preparing for the Future — Nanobodies for Covid-19?
Ram Sasisekharan, Ph.D.
Koch Institute for Integrative Cancer Research, Department of Biological Engineering, Massachusetts Institute of Technology, Cambridge.
N Engl J Med 2021; 384:1568-1571