Los chequeos del desarrollo embrionario
Nuevas investigaciones han permitido delinear un mecanismo por el cual los embriones coordinan su salida de la pluripotencia y comienzan la formación de la cavidad amniótica. En este escenario, las células indiferenciadas forman un epitelio polarizado apto para la formación de esta envoltura membranosa. Sólo cuando las células se ceban por la ausencia del factor proteico inhibidor de la leucemia, sus interfaces apicales comienzan a repelerse unas a otras, permitiendo la acumulación de fluido. Esto proporciona evidencia de que el estado ingenuo pluripotente (naive) tiene un propósito biológico clave, actuando como un punto de control para asegurar que la cavidad amniótica se forme sólo cuando las células son preparadas. De esta manera, los embriones pueden mantener la morfogénesis y la diferenciación de manera sincronizada.
Control embrionario
Durante el desarrollo embrionario, las células se diferencian en determinados linajes según la información sobre su posición en el embrión. Esta adopción de una identidad celular particular a menudo provoca cambios en la organización del embrión, lo que, a su vez, resulta en una nueva información posicional. Estos ciclos de diferenciación y morfogénesis son clave para el desarrollo normal, pero ¿cómo los coordinan los embriones? Una forma es implementar puntos de control, similares a los existentes durante el ciclo celular, para bloquear la progresión hasta que se cumplan criterios específicos. En un reciente artículo publicado por Marta Shahbazi y colaboradores, se reportó un punto de control de este tipo durante el desarrollo temprano de los mamíferos (doi: 10.1038/nature24675).
En el desarrollo de los mamíferos, el embrión forma una estructura llamada blastocisto, que contiene una masa de células pluripotentes - las que pueden dar lugar a cualquier tipo de célula del cuerpo. En la mayoría de los mamíferos, el blastocisto se implanta en el útero. La implantación puede ser detenida por las hormonas maternas, que inducen al blastocisto a segregar el factor proteico inhibidor de la leucemia (LIF) y a entrar en estado latente.
Las células pluripotentes aisladas del blastocisto para crecimiento in vitro -llamadas células madre embrionarias (CME)- pueden ser mantenidas en un estado pluripotente "ingenuo" por LIF. Cuando LIF es removido del medio de cultivo celular, las CME se "ceban" y pueden iniciar su diferenciación en los diversos progenitores que forman el cuerpo. El papel de estos diferentes estados in vivo no está claro, pero una hipótesis es que la extracción de LIF prepara al embrión para reanudar el desarrollo, constituyendo así un punto de control adecuado para la implantación.
En la fase de implantación, los embriones también experimentan un cambio de forma dramático. La cavidad amniótica, que contendrá al embrión en crecimiento y los líquidos que lo rodean, comienza a formarse dentro de un círculo de células pluripotentes preparadas. La formación de la cavidad amniótica se ha caracterizado de forma deficiente, ya que este proceso se produce en las primeras etapas de implantación embrionaria, de difícil acceso experimental. Pero en los últimos tres años, gracias al trabajo previo del grupo que llevó a cabo el estudio actual, se han obtenido conocimientos clave acerca del proceso. Los autores, junto con otros grupos, mejoraron en gran medida las condiciones de cultivo in vitro para los embriones de humanos y ratones, y lograron cultivar embriones fuera del útero hasta poco después de la etapa de implantación.
Shahbazi y colaboradores utilizaron sus sistemas de cultivo ex utero para estudiar la coordinación entre la salida de la pluripotencia y la formación de la cavidad amniótica. En primer lugar, los autores notaron que la desrregulación de los genes de pluripotencia coincidió con la aparición de la cavidad amniótica en ratones y embriones humanos. Luego, observaron que mantener las células pluripotentes en un estado ingenuo en los embriones mediante el suministro artificial de LIF impedía que las células formaran la cavidad amniótica.
Para diseccionar cuidadosamente este proceso, Shahbazi y sus colegas se enfocaron en CME de ratón. Cuando se colocan en condiciones de cultivo específicas, las CME pueden formar un epitelio - un tejido altamente organizado y cohesivo en el que las células polarizadas se alinean a lo largo de sus ejes apical-basales y forman contactos especializados llamados uniones estrechas. Y, al igual que otras células epiteliales, las CME pueden formar una estructura similar a la de la cavidad amniótica cuando crecen en sistemas de cultivo 3D. Sin embargo, los autores hallaron que las células sólo lo hacen cuando están preparadas por la eliminación de LIF. Por lo tanto, investigaron el paso específico que se controla mediante la eliminación de este factor.
Los autores determinaron que las CME naive cultivadas en cultivo 3D sufren varios de los pasos necesarios para formar una cavidad. En primer lugar, las células se disponen en estructuras de roseta circulares, con sus extremos apicales muy cercanos (figura 1). En segundo lugar, las vesículas que contienen fluidos se transportan hacia las interfaces apicales entre las células y se forman uniones estrechas. Estos pasos son requisitos previos clave para la acumulación de líquido entre las interfaces apicales. Sin embargo, los autores hallaron que las células ingenuas carecen de proteínas apicales con carga negativa, las que se extienden a través de la membrana (llamadas sialomucinas). Estas proteínas inducen la repulsión por contacto con las membranas apicales para formar uniones tipo Gap con carga negativa en el centro de la roseta. Shahbazi y sus colegas mostraron que la producción de sialomucina es inducida después de la eliminación de LIF, sugiriendo que el punto de control no es la formación de un epitelio polarizado, sino la repulsión de las superficies apicales.
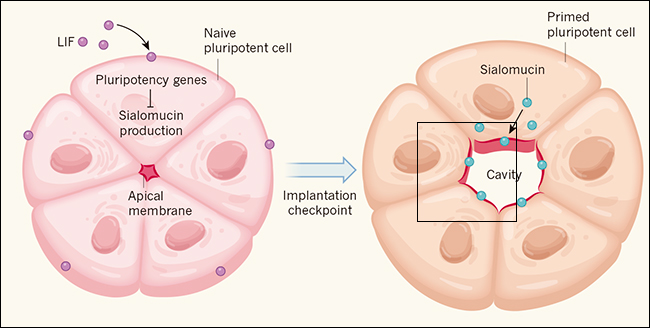
Figura 1. Un punto de control que coordina el desarrollo embrionario.
A medida que los embriones de ratón y humanos se implantan en el útero, la cavidad amniótica (que mantendrá al feto en desarrollo) comienza a formarse. Shahbazi y colaboradores (doi: 10.1038/nature24675) proporcionaron evidencia in vitro de que, antes de la implantación, las células pluripotentes ingenuas (que pueden dar lugar a todos los linajes celulares del organismo) colocan sus bordes apicales en contacto para formar una estructura polarizada de "roseta". El factor inhibidor de la leucemia de (LIF) que se secreta, promueve la expresión de genes de pluripotencia en estas células naive, y a su vez, inhiben la producción de sialomucinas - proteínas con carga negativa necesarias para la formación de la cavidad amniótica. Durante la implantación, se elimina naturalmente el LIF y las células pluripotentes se preparan para diferenciarse. En esta etapa, el transporte polarizado de sialomucinas hacia interfaces apicales hace que se repelan entre sí, dando lugar a la apertura de la cavidad. Esta disposición asegura que la implantación del embrión de mamífero esté coordinada con su desarrollo.
A continuación, los investigadores utilizaron los datos genómicos disponibles para obtener una visión mecanicista de cómo la salida de la pluripotencia controla la formación de la cavidad. Este análisis reveló un papel potencial para la proteína OCT4 en la regulación de la expresión de la sialomucina. Al considerar esta evidencia junto con la proveniente de un estudio reciente (doi: 10.1038/nature24033) que describió los efectos de la deficiencia de OCT4 en los embriones humanos preimplantacionales, el hallazgo de los autores sugiere un papel importante para OCT4 en el control del desarrollo temprano en humanos.
Aunque la expresión de sialomucinas es esencial para la formación de la cavidad, el grupo observó que la adición de estas proteínas a las células ingenuas no induce, en sí misma, la transición. Esto sugiere que la administración de sialomucinas a la interfaz apical podría requerir otras proteínas, como la cingulina, la proteína de unión estrecha, que los investigadores mostraron que se produce al eliminar LIF. La cingulina está implicada en el anclaje de las vesículas a la membrana apical, lo que indica que podría tener un papel en la formación de la cavidad.
Futuras investigaciones serán necesarias para identificar el cóctel de proteínas que es suficiente para desencadenar la formación de la cavidad. Por otra parte, queda por verificar si los eventos moleculares descritos en las CME se producen en ratones y embriones humanos. Entender cómo se regula la formación de la cavidad amniótica a nivel molecular y celular servirá de base para futuros estudios relacionados con los eventos físicos que controlan la formación de la cavidad, y sentará las bases para modelar este proceso.
Fuente bibliográfica
Early embryos kept in check.
Julien G. Dumortier & Jean-Léon Maître
Unité Génétique et Biologie du Développement, Institut Curie, PSL Research University, CNRS UMR3215, INSERM U934, 75248 Paris, France.
doi: 10.1038/d41586-017-07436-w