La inmunoterapia de los gliomas
Los gliomas de bajo grado tienen una característica particular en común: más del 70% de los casos presentan la misma mutación génica en las células tumorales. La alteración en el ADN representa el intercambio de un solo bloque de aminoácidos en una enzima llamada isocitrato deshidrogenasa 1 (IDH1). Como resultado, la mayoría de las células cancerosas no siguen el plan de construcción original para la proteína; en la posición 132 en la secuencia de la molécula, se inserta el aminoácido histidina en lugar de arginina. Ningún otro tipo de tumor muestra la misma mutación con tal frecuencia. Ahora, la proteína mutante puede detectarse utilizando un anticuerpo altamente específico.
Células T y gliomas
Los cánceres surgen como resultado de mutaciones que causan un crecimiento desenfrenado por la desregulación del ciclo celular. Un ejemplo de ello son los gliomas de grado II o III, la gran mayoría expresan una sola mutación en el gen que codifica la isocitrato deshidrogenasa 1 (IDH1). Esta mutación de sustitución (R132H) se considera origen fundamental de la iniciación de estos tumores.
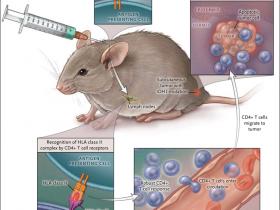
Theresa Schumacher y colaboradores (Nature 2014; 512:324-7) han informado recientemente que la secuencia de la proteína mutante puede unirse a moléculas HLA (siglas en inglés para el complejo mayor de histocompatibilidad) de clase II en células presentadoras de antígeno y por lo tanto evocar una robusta respuesta inmune en células T CD4+. En un modelo de ratón con moléculas humanas de HLA, esta respuesta inmune, cuando fue estimulada con una vacuna sintética de péptido largo con la secuencia mutante, fue capaz de erradicar los tumores que contenían unidades que albergaban la mutación (fig. 1). Este hallazgo plantea la posibilidad de obtener una vacuna terapéutica contra gliomas de mutación positiva.
Debido a que R132H es una mutación conductora, todas las células cancerosas en un paciente la expresan, imitando las posibilidades del tumor para modificar los mecanismos que permiten subvertir la respuesta inmune, aunque tal acción es todavía posible. Debido a que la respuesta inmune se dirige contra un antígeno generado por una mutación somática, llamado neoantígeno, el repertorio de células T reconoce la secuencia mutante como extraña y - en teoría - no habría limitación para la tolerancia inmunológica. De hecho, como la respuesta inmune que es evocada por la vacunación con el neoantígeno mutante, las células diana no expresan la proteína original IDH1.
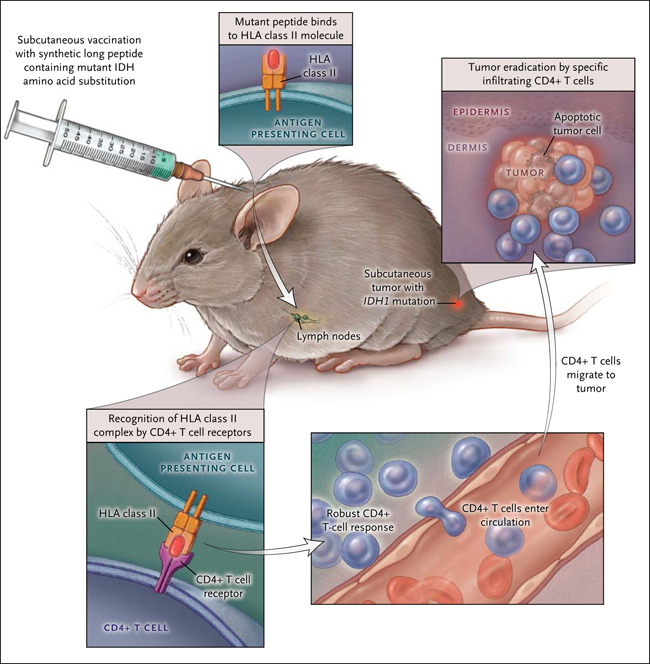
Figura 1: vacunación contra el glioma
Este estudio sugiere un enfoque experimental para el tratamiento del glioma. Aquí, el ratón recibe una inyección subcutánea de un péptido sintético adyuvante que lleva el aminoácido mutante característico de muchos gliomas humanos. Los resultados mostraron una potente respuesta de las células T CD4+ contra el péptido mutante en los ganglios linfáticos que drenaban el sitio de inyección y una fuerte supresión de los gliomas mediados por la presencia de células T CD4+.
Las células T CD4+, conocidas comúnmente como células auxiliares, promueven anticuerpos y respuestas inmunes celulares. Las T CD8+ (o células T asesinas), como su nombre lo indica, son más importantes que las células T CD4 + para la eliminación de células tumorales. Sin embargo, las T CD4+ pueden ejercer sólidas respuestas antivirales y antitumorales por su cuenta, respuestas que son utilizadas para estimular la inmunoterapia. Aunque muchas unidades cancerosas que albergan mutaciones son probablemente eliminadas antes que se hagan evidentes, las respuestas inmunes suscitadas por cánceres espontáneos son generalmente insuficientes para erradicar los tumores, incluso si tales células llevan muchas mutaciones (por ejemplo, en el cáncer de pulmón o en el melanoma inducido por la radiación ultravioleta). Esta capacidad de escapar a la detección es el resultado de una compleja serie de eventos normativos en los que el tumor se asimila como parte del tejido, evocando todos los mecanismos que suprimen la respuesta inmune y por lo tanto, impidiendo la enfermedad autoinmune. Esto no quiere decir que tales cánceres no provoquen respuestas inmunes a partir de células T; las respuestas se pierden en el microambiente del cáncer y requieren una reactivación por la inmunoterapia. Tal efecto se logra mediante el bloqueo de ciertos receptores reguladores (por ejemplo, con el antígeno 4 del linfocito T citotóxico [CTLA-4] y por la muerte celular programada 1 [PD-1]) en las células T.
El bloqueo de los puntos de control de las células T funciona mejor en los cánceres humanos con muchas mutaciones. En modelos de ratón, el bloqueo desencadena respuestas terapéuticas de las células T contra los neoantígenos mutantes. Sin embargo, como en el caso de los gliomas, las vacunas compuestas de péptidos sintéticos largos que imitan a los neoantígenos también son capaces de erradicar el tumor en ausencia de efectos secundarios autoinmunes o inflamatorios asociados al bloqueo de los puntos de control. Obviamente, la mayoría de las mutaciones generan un tumor, siendo mayor la posibilidad de producción de potentes neoantígenos capaces de provocar respuestas tumoricidas de las células T. Dicha producción se determina mediante el tratamiento adecuado de la proteína mutante y la presentación de sus antígenos por las propias moléculas de HLA del paciente. En ese sentido, la mutación conductora de glioma es inusual, ya que la mayoría de los cánceres inducidos por neoantígenos no representan mutaciones conductoras oncogénicas. Aunque las células T que son reactivas contra epítopos creados por mutaciones conductoras son adecuadas, las que son reactivas contra epítopos creados por mutaciones al azar (confiriendo ninguna ventaja de supervivencia al tumor) no son inútiles: ellas también son capaces de erradicar el cáncer.
Estos hallazgos apoyan la idea de la creación de terapias contra los tumores que alberguen mutaciones, incluyendo gliomas. Después de los antígenos virales, los neoantígenos basados en mutaciones son atractivos modelos para vacunas terapéuticas, como los péptidos sintéticos largos u otras plataformas que entreguen antígenos concentrados, como se usa en las vacunas de ADN o ARN. Y la combinación de la vacunación terapéutica con inmunomodulación por anticuerpos monoclonales contra las moléculas de los puntos de control en las células T y en contra los receptores del factor de necrosis tumoral estimuladores de células T puede mejorar aún más la eficacia de este enfoque experimental para tratar el cáncer.
Fuente bibliográfica
Mutation-Specific T Cells for Immunotherapy of Gliomas
Cornelis J.M. Melief, M.D., Ph.D.
Department of Immunohematology and Blood Transfusion, Leiden University Medical Center, and ISA Pharmaceuticals
DOI: 10.1056/NEJMcibr1501818