La era de los medicamentos GLP-1
La semaglutida y la tirzepatida no solo están trasformando el tratamiento de la diabetes tipo 2 y la obesidad, sino que también muestran potencial en una variedad de condiciones médicas. Estas innovaciones están redefiniendo el papel de la biología enteroendocrina.
Desde que Bayliss y Starling descubrieron la actividad hormonal similar a la secretina en 1902, el estudio de las hormonas intestinales, fundamentales para regular diversos procesos corporales, ha avanzado significativamente. El desarrollo de agonistas del receptor del péptido similar al glucagón-1 (GLP-1) ha revolucionado el tratamiento de la obesidad. Este logro ha llevado a que Joel Habener, Svetlana Mojsov y Lotte Bjerre Knudsen reciban el Premio de Investigación Médica Clínica Lasker-DeBakey 2024 por su destacada contribución.
En 1923, se descubrió la hormona pancreática glucagón, que actúa contrarrestando la insulina para mantener la glucemia en ayunas. Más adelante, se identificaron proteínas inmunorreactivas relacionadas, como la glicentina, en la sangre y el intestino, originadas en células enteroendocrinas. Esto anticipó el hallazgo de péptidos similares al glucagón fuera del páncreas. Habener y colaboradores, utilizando modelos animales, descifraron las secuencias genéticas del glucagón, lo que los llevó al descubrimiento de los péptidos GLP-1 y GLP-2.
Svetlana Mojsov, investigadora del Hospital General de Massachusetts en EE. UU., se centró en estudiar cómo se procesa el proglucagón para formar GLP-1. Desarrolló herramientas para identificar diferentes formas de GLP-1 en ratas, descubriendo que una forma específica, GLP-1(7–37), era abundante en el intestino. Un hallazgo importante fue que las formas truncadas de GLP-1, como GLP-1(7–37) y GLP-1(7–36), pero no GLP-1(1–37), podían estimular la liberación de insulina. Los estudios preclínicos mostraron que GLP-1(7–36) amida incrementaba rápidamente los niveles de insulina y reducía los de glucagón en personas sanas, mejorando así la respuesta del cuerpo a la glucosa (figura 1).
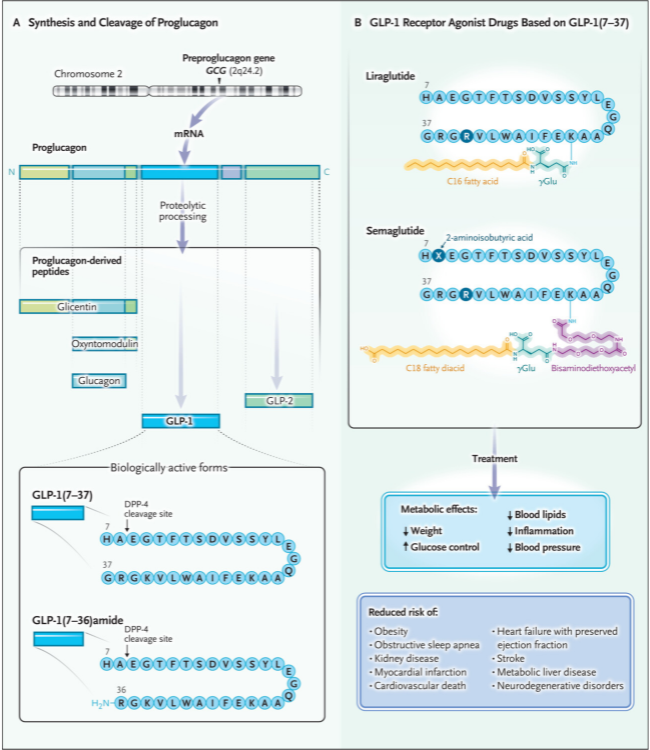
Figura 1: actividad biológica y beneficios farmacológicos del GLP-1.
La búsqueda de medicamentos que replicaran el efecto del GLP-1 nativo para tratar la diabetes tipo 2 enfrentó dificultades debido a su rápida degradación y efectos secundarios como náuseas y vómitos cuando se infundía rápidamente. En 2005, se aprobó la exenatida, derivada de la saliva de lagarto, como el primer medicamento análogo del GLP-1, pero requería administración dos veces al día y no proporcionaba activación continua del receptor. Para mejorar esto, Lotte Knudsen y su equipo en Copenhague desarrollaron la liraglutida, un análogo del GLP-1 humano resistente a la degradación por dipeptidil peptidasa 4 (DPP-4). Mediante la unión a la albúmina, la liraglutida prolongó su vida media, convirtiéndose en el primer medicamento GLP-1 de acción prolongada aprobado para mantener el control glucémico continuo durante 24 horas en la diabetes tipo 2.
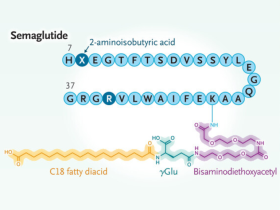
Los tumores que secretan glucagón, llamados glucagonomas, pueden causar pérdida de peso, ya que el glucagón reduce el apetito y aumenta el gasto energético. Algunos también producen altos niveles de GLP-1. En 1996, se descubrió que el GLP-1 administrado directamente en el cerebro de roedores reducía su ingesta de alimentos. Aunque la exenatida y la liraglutida, usadas para diabetes tipo 2, lograban una pérdida de peso moderada (1% al 3%), la preocupación por sus efectos secundarios frenó su uso en dosis altas. Sin embargo, Knudsen y su equipo demostraron que dosis mayores de liraglutida (2,4 mg y 3 mg) generaban una pérdida de peso significativa en personas con obesidad, lo que llevó a su aprobación en 2014 como el primer medicamento GLP-1 para perder peso. La introducción de la semaglutida, una molécula más resistente a la DPP-4 y de dosificación semanal, y la tirzepatida, un coagonista de GLP-1, permite ahora una reducción de peso del 15% al 20% o más en personas con obesidad o sobrepeso con complicaciones médicas.
El desarrollo de terapias para bajar de peso ha enfrentado problemas de seguridad, como riesgos neuropsiquiátricos, cardiovasculares y de cáncer, que llevaron a la retirada de algunos medicamentos del mercado. Sin embargo, los medicamentos GLP-1 de acción prolongada han demostrado ser seguros y eficaces en personas con diabetes tipo 2 y riesgo cardiovascular. En 2023, estudios mostraron que la semaglutida redujo los eventos cardiovasculares adversos en un 20% en personas con antecedentes de enfermedad cardiovascular y obesidad. Tanto la semaglutida como la tirzepatida mejoraron síntomas de insuficiencia cardíaca con fracción de eyección preservada en personas con obesidad. Además, la semaglutida disminuyó el riesgo de enfermedad renal y cardiovascular en pacientes con diabetes tipo 2, y la tirzepatida mejoró los síntomas de la apnea obstructiva del sueño en participantes obesos.
El avance de los medicamentos análogos del GLP-1 y sus beneficios terapéuticos, más allá de solo la reducción de peso (figura 1), ha renovado el interés en estas terapias. Si bien el enfoque principal continúa siendo mejorar la efectividad en la pérdida de peso, se están investigando combinaciones de GLP-1 con otros péptidos para tratar la enfermedad hepática metabólica, enfermedad arterial periférica, párkinson, alzhéimer y varios trastornos neuropsiquiátricos. Estamos posiblemente al comienzo de una nueva era en la biología enteroendocrina y el desarrollo de medicamentos GLP-1, con muchas innovaciones aún por venir.
Fuente bibliográfica
Discovery of GLP-1–Based Drugs for the Treatment of Obesity
Daniel J. Drucker, M.D.
Department of Medicine, Lunenfeld–Tanenbaum Research Institute, Mt. Sinai Hospital, University of Toronto
DOI: 10.1056/NEJMcibr2409089