Inmunoterapia para la fibrosis cardíaca
La fibrosis puede observarse en casi todas las formas de enfermedad miocárdica. En caso de lesión, los fibroblastos del corazón comienzan a remodelar el miocardio depositando el exceso de matriz extracelular, lo que resulta en un aumento de la rigidez del tejido. La fibrosis cardíaca excesiva es un factor importante en la progresión de varias formas de enfermedad e insuficiencia cardíaca. Sin embargo, las intervenciones clínicas y los tratamientos dirigidos a la fibrosis siguen siendo limitados. Al respecto, un reciente estudio muestra la eficacia de la inmunoterapia redireccionada con células T para atacar específicamente la fibrosis cardíaca en ratones. Se evidenció que los fibroblastos cardíacos que expresan un antígeno xenogénico pueden ser dirigidos y ablacionados de forma efectiva mediante la transferencia adoptiva de células T CD8+ específicas para el antígeno. A través del análisis de la expresión de los fibroblastos obtenidos de corazones humanos sanos y enfermos, se identificó un objetivo endógeno de los fibroblastos cardíacos: la proteína de activación de los fibroblastos (FAP). La transferencia adoptiva de células T que expresan un receptor de antígeno quimérico contra FAP da como resultado una reducción significativa de la fibrosis cardíaca y la restauración de la función después de la lesión en ratones. Estos resultados proporcionan una prueba de concepto para el desarrollo de medicamentos inmunoterapéuticos para el tratamiento de enfermedades cardíacas.
Células T CAR
La deposición de la matriz extracelular en un tejido afectado por enfermedad se produce en diversos órganos y contextos patológicos. La fibrosis resultante puede tener características adaptativas a corto plazo, pero con el tiempo deteriora la función tisular. En el corazón, la fibrosis se divide comúnmente en dos tipos: reactiva y de reemplazo. El primer tipo de fibrosis se produce en los espacios perivasculares, de forma similar a las respuestas fibrogénicas en otros tejidos; la fibrosis de reemplazo se produce en los sitios de pérdida de cardiomiocitos. Mientras que la fibrosis cardíaca ayuda a mantener la integridad del tejido durante el infarto de miocardio, la fibrosis crónica altera la función mecánica y perturba la excitación eléctrica y la repolarización. Los septos ventriculares colágenosos contribuyen a la arritmogénesis al interrumpir la conducción lenta continua y desencadenar la actividad espontánea a través de los miofibroblastos acoplados eléctricamente. No es sorprendente que exista un interés de larga data en identificar estrategias terapéuticas para disminuir la fibrosis y restaurar la estructura y función cardíaca normal. Es así como un estudio recientemente descrito por Aghajanian y colaboradores cae en terreno fértil en relación con esta materia (DOI: 10.1038/s41586-019-1546-z).
Los eventos celulares desencadenados por el estrés relacionado con la enfermedad implican múltiples tipos celulares, incluyendo fibroblastos y miofibroblastos, culminando finalmente en la elaboración de un exceso de matriz extracelular. Como consecuencia, se generan cambios en determinados eventos intracelulares, incluyendo la biosíntesis de colágenos intersticiales, fibronectina, laminina y otros elementos menos abundantes, así como la supresión de la transformación y activación de los miofibroblastos. De hecho, se han propuesto cuatro fases de la respuesta fibrogénica y es posible imaginar enfoques terapéuticos dirigidos a cualquiera de ellas. El tejido fibrótico parenquimatoso es dinámico -puede progresar o reabsorberse- y no es una "cicatriz de cuero" fija e inmutable, por lo que se ha discutido ampliamente la promoción de la regresión de la fibrosis. Sin embargo, hay pocas terapias efectivas y ninguna que se dirija específicamente a la fibrogénesis.
La novedosa estrategia descrita por Aghajanian y sus colegas consiste en liberar el sistema inmunológico para eliminar la cicatrización del parénquima (figura 1). Basándose en los avances en la inmunoterapia del cáncer, los investigadores utilizaron terapia de células T con receptor de antígeno quimérico (CAR). Estas células expresan receptores sintéticos con la especificidad de un anticuerpo monoclonal junto con el poder citolítico de una célula T que funciona independientemente del complejo mayor de histocompatibilidad. En primer lugar, en un experimento de prueba de concepto en ratones, los investigadores diseñaron corazones mutantes que expresan una proteína foránea en los miofibroblastos, las células responsables en gran medida de la fibrogénesis en el corazón, y diseñaron linfocitos T para dirigirse a las células que expresan esa proteína. En la entrega exógena de las células T manipuladas a ratones mutantes (transferencia de células adoptivas), las células T trabajaron destruyendo los miofibroblastos, llevando a una disminución de la fibrosis cardiaca.
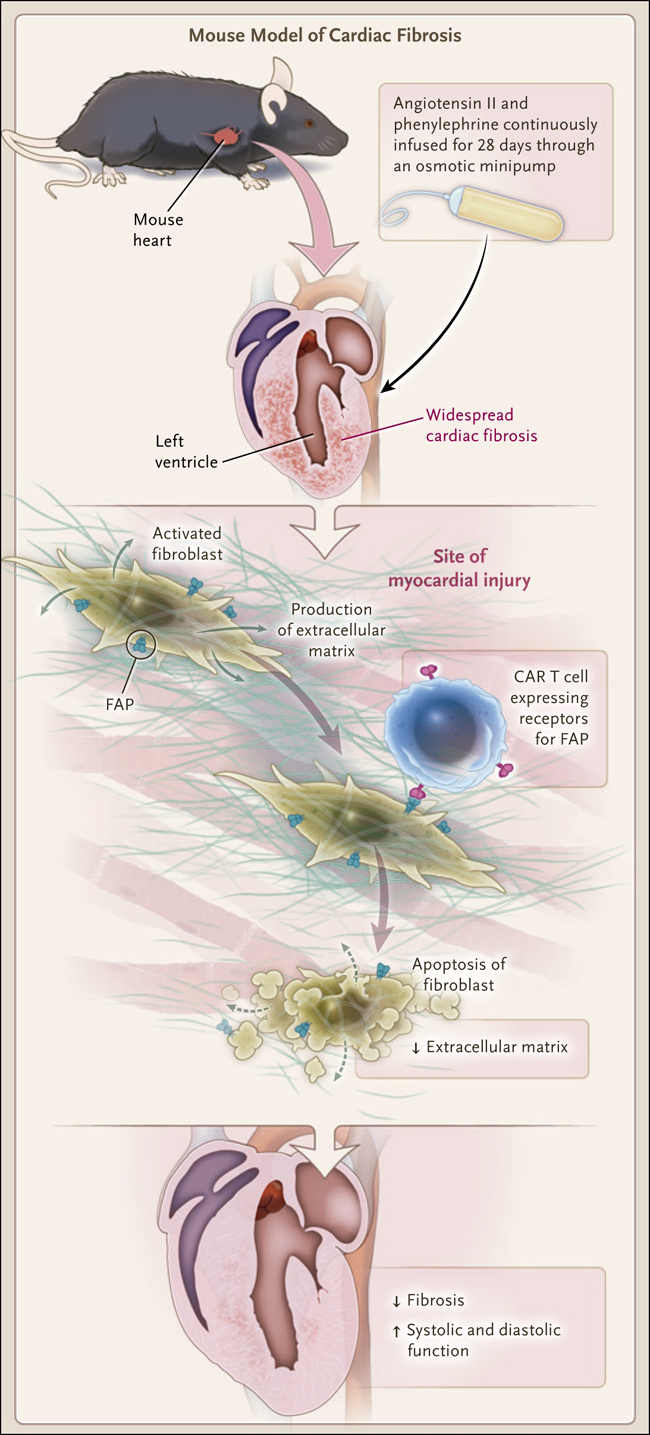
Figura 1. Combatiendo la fibrosis con células T CAR.
Utilizando un modelo de lesión cardíaca establecido en ratones que implicaba la infusión continua de angiotensina II y fenilefrina durante una semana, Aghajanian y sus colaboradores encontraron una fibrosis generalizada en el miocardio después de la primera semana de tratamiento. En ese momento, se infundieron en los ratones células T con receptor de antígeno quimérico (CAR) específicas para la proteína de activación de fibroblastos (FAP), y se observaron células T CAR infiltradas en el parénquima miocárdico al día siguiente del tratamiento, colocalizándose con los fibroblastos. Tres semanas más tarde, los investigadores observaron una reducción significativa en la extensión de la fibrosis que persistió hasta 7 semanas después del tratamiento.
A continuación, los investigadores buscaron proteínas relacionadas con la fibrogénesis que están sobrerreguladas en las enfermedades cardíacas humanas -específicamente, en la miocardiopatía hipertrófica y la miocardiopatía dilatada- y luego buscaron la proteína de activación de fibroblastos (FAP), una glucoproteína de membrana expresada en ciertas subclases de fibroblastos. Aprovechando la existencia de linfocitos T modificados que se dirigen a la FAP y que se habían probado previamente en el cáncer (DOI: 10.1126/science.aaa4967), los investigadores observaron que la transferencia adoptiva de estas células en varios modelos de remodelación cardíaca patológica en ratones disminuía la fibrosis, aumentaba de forma brusca la masa ventricular y promovía cierto grado de mejora en la función contráctil. No se detectó ninguno de los efectos secundarios más preocupantes de las terapias con linfocitos T modificados, incluyendo eventos fuera del objetivo e inflamación marcada por aumentos de diversas citoquinas, aunque los resultados de un ensayo de expresión génica apoyaron la presencia de inflamación leve. La fibrosis perivascular miocárdica persistió en los ratones tratados, un hallazgo consistente con los datos previos que muestran que los fibroblastos perivasculares no expresan FAP. La cicatrización de la herida no se vio perturbada.
Este trabajo apunta a una nueva estrategia terapéutica para atacar la fibrosis en el corazón y en otros lugares. Cabe destacar que la fibrosis pulmonar parece ser menos plástica que la fibrosis que se produce en otros tejidos (DOI: 10.1056/NEJMra1300575), por lo que este enfoque merece ser evaluado en el pulmón. Además, el estudio plantea nuevas e importantes preguntas. ¿Sería esta terapia efectiva para tratar la fibrosis establecida? ¿Podría ajustarse el efecto de las células T CAR, para que las características adaptativas de la fibrosis, asumiendo que existen, se mantengan? Dado que la FAP se secreta en algunos contextos, ¿la matriz podría ser un blanco? ¿Podría utilizarse este enfoque en el tratamiento de pacientes con arritmias causadas por cicatrices? Debido a que la terapia con células T CAR sigue siendo experimental, se justifica la precaución: han surgido numerosos informes de efectos fuera del objetivo, algunos de ellos con consecuencias catastróficas. Las troponinas cardíacas circulantes están establecidas desde hace mucho tiempo como los biomarcadores más informativos de lesión cardíaca, y las pruebas para ellas serán importantes en el futuro. Como mencionaron los autores, parece prudente diseñar un gen suicida en las células T para que la activación inmunológica que se dirige a la fibrosis pueda detenerse. Dicho esto, Aghajanian y sus colegas han mostrado una nueva y emocionante estrategia dirigida, en un modelo de ratón, a un problema de larga data en la medicina cardiovascular.
Fuente bibliográfica
When the CAR Targets Scar
Joseph A. Hill, M.D., Ph.D.
Departments of Internal Medicine (Cardiology) and Molecular Biology, University of Texas Southwestern Medical Center, Dallas.
NEJMcibr1912586