Enfoques moleculares para mejorar la hemofilia
El sistema hemostático equilibra la necesidad de controlar la pérdida de sangre con la prevención de la trombosis. En la hemofilia, la carencia de ciertos factores procoagulantes (Factor VIII y Factor IX), en el caso de la hemofilia A y B, respectivamente) genera una oscilación del sistema hemostático hacia un fenotipo hemorrágico. Curiosamente, existen informes que sugieren que la herencia de mutaciones protrombóticas (por ejemplo, el factor V Leiden, la deficiencia de proteína C, deficiencia de proteína S, la deficiencia de antitrombina, la protrombina G20210A) puede mejorar el fenotipo clínico de los pacientes. Actualmente se está investigando el uso de ARN de interferencia (ARNi) para dirigirlo a anticoagulantes naturales (AT) como estrategia que pueda reequilibrar el sistema hemostático y mejorar la generación de trombina en la hemofilia.
Antitrombina y hemofilia
La hemofilia es un trastorno hemorrágico ligado al cromosoma X que resulta de una deficiencia del factor de coagulación VIII o IX (que causa la hemofilia A o B, respectivamente) y se caracteriza por un sangrado espontáneo y traumático a nivel muscular, en las articulaciones y en las cavidades del cuerpo. El tratamiento es muy caro, con un costo anual de miles de dólares para un adulto promedio, y sus complicaciones a menudo agravan la enfermedad, deterioran la calidad de vida, generan requerimientos ortopédicos y quirúrgicos, y una vida más corta. Para evitar hemorragias y complicaciones, el factor de coagulación faltante se sustituye varias veces a la semana a través de infusiones intravenosas, denominada "profilaxis", que comienza durante la infancia. A pesar de los avances en la fabricación del factor de coagulación, incluyendo tecnologías recombinantes y de vida media prolongada, que han dado lugar a tratamientos más seguros y simples, muchos problemas permanecen. Hasta el 50% de los adultos abandona la profilaxis porque es invasiva e inconveniente, y un 25% desarrolla anticuerpos inhibidores, que hacen que el factor infundido sea ineficaz y conduzca a una elevada morbilidad y mortalidad. El desarrollo de un tratamiento más simple, menos invasivo y costoso, es una meta a alcanzar.
Condiciones protrombóticas, tales como la deficiencia de antitrombina y de proteínas C y S, tienen una influencia moderadora sobre la gravedad clínica de la hemofilia, y este fenómeno ha promovido el interés en la creación de una deficiencia de los inhibidores de coágulos para reducir la gravedad de la enfermedad. Lo atractivo de inhibir la antitrombina es que elimina el inhibidor natural de la trombina (factor IIa), y el efecto neto hemostático es un sangrado menos severo; lo que se ha podido demostrar en modelos de ratón para la hemofilia A, mejorando la homeostasis después de la depleción de la antitrombina.
Estas observaciones han llevado al desarrollo de un nuevo agente prohemostático, que ahora está siendo evaluado en un ensayo clínico de fase 1. En particular, en lugar de sustituir la falta del factor VIII o IX, se usa la eliminación de los inhibidores de coagulación para lograr la hemostasia en los pacientes. En un reciente estudio sobre la hemofilia A realizado en ratones y primates no humanos, Alfica Sehgal y colegas (Nat Med 2015; 21: 492-7) utilizaron un ARN pequeño de interferencia (ARNip, en inglés: siRNA) para disminuir la antitrombina III mediante la prevención de su síntesis; esto llevó a una mejor hemostasia y a la reducción de la hemorragia (el sangrado no fue evaluado en primates). Ellos plantearon la hipótesis que el uso de este agente (denominado en lo sucesivo como antitrombina III ARNip) bloquearía la síntesis de antitrombina III, entonces, el inhibidor clave de la trombina promovería la hemostasia mediante la prevención de la inhibición de la trombina, incluso en ausencia de factor VIII (fig. 1).
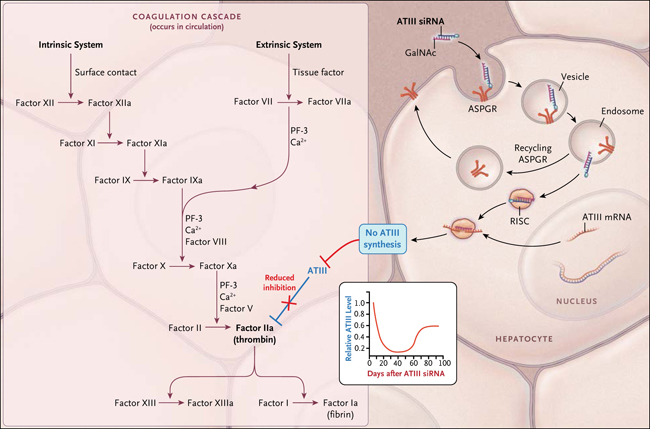
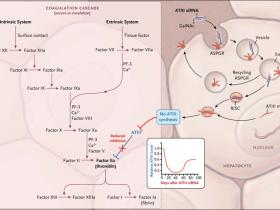
Figura 1: el silenciamiento de la antitrombina III (ATIII) que promueve la hemostasia
A la derecha, el ARN pequeño de interferencia (ARNip, en inglés: siRNA) conjugado con N-acetilgalactosamina (GalNAc) se une al receptor de asialoglicoproteína de hepatocitos (ASPGR), permitiendo la entrada en la célula, la endocitosis, y, después de la vinculación con ARN mensajero de ATIII (ARNm), la inhibición de la síntesis de ATIII postranscripcional. El silenciamiento del ARN se activa cuando el ARN de doble cadena se escinde en ARNip, y la cadena con sentido se elimina, dejando una cadena antisentido complementaria al gen diana, que silencia al gen. El gráfico indica una inhibición significativa de la síntesis de ATIII, lo que resulta en la formación de trombina sin corregir en la cascada de coagulación (recuadro de la izquierda); permitiendo la formación fisiológica de coágulos de fibrina.
¿Cómo funciona y qué tan segura es la tecnología ARNip? Su historia comenzó en la década de 1990, cuando biólogos de plantas observaron accidentalmente que mediante la inserción de dos copias del gen que codifica el color púrpura de las petunias, las flores púrpuras se volvían blancas o moteadas de blanco y púrpura. Este cambio de color se atribuyó al silenciamiento de los "genes flores púrpura", lo que también se producía después de la inyección de un pequeño fragmento de ARN del gen de la planta. Más tarde se determinó que el mecanismo del cambio de color es un bloqueo del ARN mensajero (ARNm) por ARNip. Los fragmentos de ARN también eran capaces de silenciar genes en células de mamíferos, incluyendo los hepatocitos. Debido a que son complementarios a las secuencias de un ARNm celular, los ARNip provocan el degradado del ARNm diana, silenciando de este modo la expresión del gen. Teleológicamente, se cree que el ARNip desempeña un papel en la estabilización del genoma al silenciar genes repetitivos y también a los virus.
En el caso de ARNip dirigidos a los hepatocitos, se encontró que conectar una N-acetilgalactosamina (GalNAc) a ARNip mejoraba su unión a la de los hepatocitos a través del receptor de asialoglicoproteína y también se protegía de la digestión por RNasas. El equipo de Alfica Sehgal utilizó este enfoque al administrar antitrombina III ARNip por vía subcutánea a ratones tipo salvaje, un modelo de ratón para la hemofilia A, y a primates no humanos, encontrándose una reducción dosis-dependiente en la antitrombina III. De hecho, se observó una reducción del 50% en la antitrombina III en primates no humanos después de una sola dosis subcutánea semanal de ARNip. En modelos de ratón y de primates no humanos para la hemofilia A, los autores observaron una corrección dosis-dependiente del tiempo de tromboplastina parcialmente activada y la mejora en la generación de trombina, así como una reducción en la hemorragia, sin trombosis.
¿Qué significa este nuevo agente terapéutico para los pacientes con hemofilia? El potencial para disminuir el sangrado en individuos hemofílicos, con o sin inhibidores, con una sola dosis subcutánea semanal, podría cambiar la vida. Sería un gran avance mejorar la protección del sangrado con una simple inyección subcutánea una vez por semana, de forma menos invasiva. Suponiendo que similares efectos hemostáticos estén presentes en pacientes con hemofilia tratados con antitrombina III ARNip, el costo será factor importante al adoptar este tipo de terapia, y, sobre todo, se necesitarán ensayos clínicos para garantizar la seguridad y eficacia de este nuevo tratamiento.
Fuente bibliográfica
Targeting Antithrombin to Treat Hemophilia
Margaret V. Ragni, M.D.
Department of Medicine, Division of Hematology–Oncology, University of Pittsburgh, and the Hemophilia Center of Western Pennsylvania.
DOI: 10.1056/NEJMcibr1505657