Embestida contra bacterias persistentes
El uso de antibióticos para tratar una infección puede ser infructuoso cuando las bacterias evaden tales medicamentos a través de modificaciones genéticas que les confieren resistencia. Estos microorganismos también pueden evitar la destrucción mediada por antibióticos por medio de otra vía: entran en un estado metabólicamente inactivo o latente para convertirse en células persistentes, que crecen lentamente o no crecen en absoluto. La mayoría de los antibióticos fueron descubiertos en experimentos que probaron su capacidad para inhibir el crecimiento bacteriano, y por lo tanto a menudo son ineficaces para el tratamiento de células persistentes que no están en ese estado. Sin embargo, recientemente un estudio reporta la identificación de pequeñas moléculas retinoides capaces de eliminar selectivamente bacterias persistentes.
Retinoides dirigidos a la membrana
Las bacterias persistentes son la fuente de muchas de las infecciones recurrentes, por ejemplo, las asociadas con dispositivos médicos implantados, como la endocarditis por infección cardíaca, y también las infecciones pulmonares que pueden surgir en la fibrosis quística. La resolución de estas infecciones crónicas puede requerir cirugía, lo que supone una carga adicional para la salud de los pacientes. Y cualquier período prolongado necesario de tratamiento con antibióticos aumentará la probabilidad de que las bacterias desarrollen resistencia. Por lo tanto, es urgente el desarrollo de terapias para eliminar las células persistentes, especialmente para tratar a las que surgen en infecciones con cepas de Staphylococcus aureus resistente a la meticilina (SARM), que es resistente a varios antibióticos comunes. La infección por SARM está asociada con la enfermedad y la muerte, particularmente entre las personas con infecciones invasivas.
En un reciente estudio, Wooseong Kim y colaboradores (doi:10.1038/nature26157) decidieron buscar moléculas que pudieran ofrecer protección contra la infección por SARM, utilizando como modelo el sistema de Caenorhabditis elegans. Con un enfoque de alto rendimiento, los autores probaron la capacidad de alrededor de 82.000 moléculas sintéticas pequeñas para proteger a los gusanos de la muerte inducida por la infección. De los 185 compuestos que otorgaron protección, los autores se centraron en dos moléculas llamadas CD437 y CD1530, las cuales matan rápidamente a las bacterias multiresistentes y que son específicas para Enterococcus faecium, microorganismo vinculado a la endocarditis. Desafortunadamente, estos compuestos no tuvieron efecto contra bacterias Gram-negativas - grupo que incluye Escherichia coli - para las cuales se necesitan desesperadamente nuevas opciones terapéuticas debido a que también pueden originar "superbacterias" resistentes a los antibióticos.
CD437 y CD1530 pertenecen a una clase de moléculas conocidas como retinoides, que son estructuralmente similares a la vitamina A. Desde la década de 1960, los retinoides se han desarrollado para tratar diversas afecciones, incluido el acné (doi: 10.1021/cr400126u). La posterior modificación sintética de los retinoides ha generado, por tanto, derivados que a menudo están presentes en las bibliotecas químicas utilizadas para el descubrimiento de nuevos fármacos.
Los autores concluyeron que la muerte rápida de las células de SARM ocurre cuando las dos moléculas retinoides distorsionaron la estructura de la bicapa lipídica de la membrana bacteriana. Kim y sus colegas luego llevaron a cabo estudios de microscopía electrónica, los cuales revelaron que el tratamiento retinoide causaba curvatura y plegamiento de la membrana bacteriana, pero no resultaba en la destrucción de la membrana.
La membrana bacteriana es una barrera de permeabilidad esencial para muchas funciones celulares, y contiene proteínas que son cruciales para controlar la absorción de nutrientes, la liberación de desechos y la producción de energía en forma de moléculas de ATP. Al distorsionar la membrana, las moléculas retinoides probablemente afectan la importación y exportación de solutos, así como otras funciones celulares esenciales que dependen de la integridad de la membrana. Sin embargo, un modo de acción antibacteriano que consiste simplemente en atacar la membrana bacteriana no garantiza la muerte de las células persistentes. Por ejemplo, los autores informan que los antibióticos dirigidos a la membrana nigericina y valinomicina no eliminan a las células persistentes de SARM.
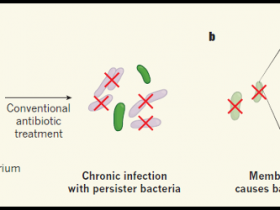
Figura 1. Un compuesto retinoide que destruye las células persistentes bacterianas.
a, Las poblaciones bacterianas comúnmente consisten en células que se dividen rápidamente y células de crecimiento lento que se conocen como células persistentes. Cuando las bacterias son tratadas con antibióticos convencionales, las células que se dividen rápidamente son destruidas. Sin embargo, las persistentes pueden permanecer, dando lugar a una infección crónica. b, Kim y sus colegas (doi:10.1038/nature26157) reportaron un compuesto retinoide llamado análogo 2 que fue optimizado para atacar bacterias persistentes. En un modelo de ratón de infección bacteriana, los autores encontraron que el análogo 2 podría matar a las células persistentes. La microscopía electrónica y la modelización por ordenador revelaron que el análogo 2 probablemente se une a las moléculas fosfolipídicas de la membrana bacteriana, resultando en su distorsión que podría ayudar a eliminar las bacterias.
A través de simulaciones por computadora, los autores exploraron cómo las moléculas retinoides podrían interactuar con la membrana bacteriana. Determinaron que los grupos laterales polares de CD437 y CD1530 podían unirse a las cabezas hidrofílicas de los fosfolípidos en la membrana, permitiendo que las moléculas retinoides se alojaran en la bicapa lipídica de una bacteria. Tales simulaciones son una poderosa herramienta que podría ser usada para guiar la optimización de los antibióticos que pueden atacar selectivamente la bicapa lipídica de las membranas bacterianas sin interrumpir sus contrapartes mamíferas ni causar toxicidad a los pacientes.
Una preocupación importante es cómo optimizar pequeñas moléculas como los retinoides para permitir tal selectividad. Aunque los autores evidenciaron que CD437 y el CD1530 no destruyen las membranas lipídicas de glóbulos rojos humanos, las moléculas fueron capaces de matar células humanas de cáncer de hígado cultivadas in vitro, lo cual es consistente con las propiedades anticancerígenas previamente reportadas de los retinoides.
Los autores generaron variantes estructurales de CD437, produciendo un compuesto que llamaron análogo 2 que no eliminaba las células hepáticas humanas normales o las cancerosas que crecían in vitro, pero sí retenía la capacidad de destruir bacterias persistentes de SARM (figura 1). En experimentos con ratones, el análogo 2 permaneció en circulación en el cuerpo de los animales durante varias horas a concentraciones lo suficientemente elevadas como para matar estas bacterias, sin originar signos de toxicidad como daño hepático o renal. Sorprendentemente, los autores demostraron que el análogo 2 podía abordar lo que generalmente se consideraría una forma de SARM resistente al tratamiento. Este modelo animal imita la infección crónica con con SARM en personas inmunocomprometidas, para quienes el pronóstico es deficiente con los antibióticos convencionales como la vancomicina debido al gran número de células persistentes que están presentes.
Los autores encontraron que los efectos del análogo 2 sobre las infecciones bacterianas podrían verse reforzados por la presencia de gentamicina, un inhibidor de la síntesis proteica bacteriana que carece de actividad contra las células persistentes. Será interesante determinar si las bacterias persistentes de SARM responden a los retinoides mediante la reactivación de su metabolismo celular, haciéndolas así más susceptibles a ser eliminadas por fármacos como la gentamicina, que de otro modo serían ineficaces.
Moléculas como el análogo 2 pueden ser candidatos adecuados para medicamentos que disminuyan el tiempo necesario para tratar con éxito infecciones crónicas caracterizadas por altas cargas de bacterias latentes. En una época en la que el desarrollo de antibióticos está luchando por seguir el ritmo de la propagación de bacterias resistentes, la identificación de compuestos como el análogo 2 podría ayudar a investigadores y médicos a ganar victorias en la larga pelea contra las enfermedades infecciosas bacterianas.
Fuente bibliográfica
Bacterial persister cells tackled
Julian G. Hurdle & Aditi Deshpande
Center for Infectious and Inflammatory Diseases, Institute of Biosciences and Technology, Texas A&M Health Science Center, Houston, Texas 77030, USA.
doi: 10.1038/d41586-018-03440-w