El responsable de los huesos fuertes tras la lactancia
El descubrimiento del factor CCN3 como regulador clave de la masa ósea marca un hito en la comprensión de la salud esquelética durante este periodo posnatal, abriendo nuevas posibilidades para el tratamiento de fracturas y la osteoporosis.
La lactancia es fundamental para la vida, ya que proporciona nutrientes esenciales a los bebés y ofrece múltiples beneficios tanto para ellos como para las madres. Además de sus aspectos nutricionales, inmunológicos y psicosociales, la lactancia asegura la transferencia de calcio al recién nacido, crucial para su desarrollo esquelético. Durante la gestación se les transfieren aproximadamente 30 g de este mineral. Esta transferencia que hace la madre se compensa con una mayor absorción del calcio en los intestinos, mediada por el péptido relacionado con la hormona paratiroidea (PTHrP), que se produce en la placenta y las mamas. El PTHrP induce la síntesis de la enzima 1α-hidroxilasa en los riñones para producir calcitriol, la forma activa de la vitamina D. Esta adaptación endocrina, influenciada por altos niveles de estradiol al final del embarazo, garantiza un nivel de calcio estable y minimiza la pérdida ósea materna, protegiendo así su esqueleto.
Sin embargo, la adaptación endocrina durante la lactancia es significativamente diferente de la que ocurre durante la gestación, con una reducción del doble en el nivel de calcio materno (figura 1). Una disminución posnatal en el nivel de estradiol, combinada con una mayor producción de PTHrP en el tejido mamario, activa la vía del ligando del activador del receptor del factor nuclear κB (RANKL). Esto promueve la diferenciación y activación de los osteoclastos, células encargadas de descomponer el hueso, liberando así calcio hacia la leche materna. Durante la lactancia, el PTHrP también intensifica la osteólisis osteocítica, proceso que afecta principalmente al hueso esponjoso o trabecular, ocasionando una pérdida ósea de entre el 6% y el 8% en la columna lumbar después de seis meses de lactancia en humanos. Aunque en menor medida, la estructura ósea cortical también se ve afectada.
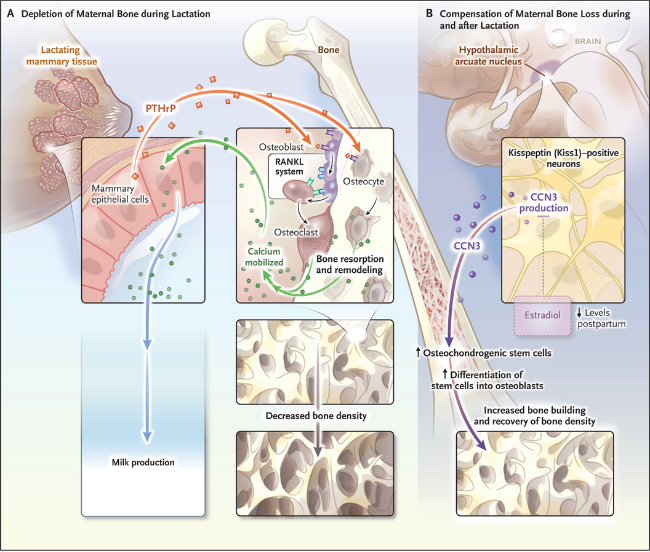
Figura 1: adaptación esquelética en la lactancia
Al finalizar la lactancia, los niveles de PTHrP y RANKL disminuyen, lo que beneficia la recuperación ósea. Pero, ¿cómo se regenera el esqueleto materno? Un estudio de Babey y colaboradores de la Universidad de California, EE. UU., sugiere la participación de un circuito neuroesquelético recién descubierto. Según los autores, las neuronas Kiss1 en el núcleo arqueado del hipotálamo secretan una hormona que promueve la formación ósea durante la lactancia. Al eliminar los efectos limitantes de la señalización de estrógenos en estas neuronas de ratones hembra, mediante la ablación del receptor de estrógeno alfa, observaron un notable incremento en el volumen óseo. Este aumento se atribuyó a la presencia de células madre esqueléticas más activas en la osteogénesis.
Para identificar el factor anabólico cerebral que promueve la formación ósea, sometieron a los ratones a una dieta alta en grasas, conocida por afectar este tipo de neuronas, lo que resultó en pérdida ósea. La secuenciación de ARN de fragmentos del núcleo arqueado hipotalámico de estos ratones reveló la presencia del factor 3 de la red de comunicación celular hormonal (CCN3) en las neuronas de los ratones control, carentes del receptor de estrógeno alfa (figura 1). El CCN3 no se encontró en ratones de tipo salvaje ni en machos sometidos a la ablación del receptor de estrógeno alfa.
La administración de CCN3 aumentó la masa ósea en ratones tanto jóvenes como adultos, además de mejorar la reparación de fracturas y la fuerza en los animales mayores. En contraste, la supresión temporal de CCN3 en las neuronas Kiss1 de ratones hembra con el receptor de estrógeno alfa eliminado resultó en una reducción de la masa ósea, proporcional al grado de inhibición de dicho factor.
Por otro lado, la sobreexpresión de CCN3 en el hígado mejoró la masa y la fuerza ósea en ratones sin ninguna alteración hormonal y en aquellos que se les había extirpado los ovarios mediante un mecanismo osteoanabólico. Cabe destacar que la expresión de CCN3 estuvo ausente durante el embarazo, pero aumentó siete días después del parto durante la lactancia, para luego disminuir nuevamente con el destete forzado. Para confirmar la función de CCN3 durante la lactancia, este se suprimió en el núcleo arqueado hipotalámico de los animales antes del embarazo. Cuando las madres fueron alimentadas con una dieta baja en calcio, sus crías no prosperaron.
Si estos hallazgos se validan en experimentos con células humanas y modelos humanizados, el papel neuroendocrino de CCN3, descrito por Babey y su equipo, podría tener importantes implicaciones. Con el desarrollo de herramientas efectivas para evaluar la expresión de CCN3, se podrá investigar su implicación en la patogénesis de enfermedades humanas, especialmente en la osteoporosis inducida por la lactancia. Dado que las neuronas Kiss1 regulan el equilibrio energético y la liberación de la hormona gonadotropina, influyendo en la reproducción femenina y la pubertad, se puede plantear la hipótesis de que las alteraciones en la secreción de CCN3 en estas neuronas podrían contribuir a la fragilidad ósea y a la baja formación de los huesos en mujeres con pubertad tardía, anorexia nerviosa o aquellas que enfrentan una deficiencia energética relativa en el ámbito deportivo, una condición anteriormente conocida como la tríada de la atleta femenina.
En vista de que el factor CCN3 funciona como un interruptor que cambia de un estado catabólico a uno anabólico, se podrían explorar estrategias terapéuticas para aumentar o prolongar su secreción endógena, o bien para administrar análogos de CCN3. Sin embargo, es fundamental validar los hallazgos de esta investigación. Estas estrategias podrían mejorar la resistencia ósea tanto en mujeres como en hombres, e incluso favorecer la recuperación de fracturas óseas, un desafío importante en el ámbito de la medicina ósea.
Fuente bibliográfica
Building Bone while Making Milk
Lorenz C. Hofbauer, M.D.
University Center for Healthy Aging and the Division of Endocrinology, Diabetes, and Bone Diseases, Department of Medicine 3, Technische Universität Dresden, Dresden, Germany
N Engl J Med 2024;391:2052-2054