Edición génica para recuperar la audición
Las formas autosómicas dominantes y recesivas de la pérdida auditiva hereditaria son causadas por una mutación en el gen Tmc1 que codifica una proteína tipo canal iónico que es fundamental para la mecanotransducción en células ciliadas conectadas al nervio auditivo. Esta mutación se ha descrito en modelos animales y en humanos. Recientemente, se logró inactivar específicamente el alelo anómalo de este gen mediante la técnica CRISPR-Cas9, complejo que al unirse a la secuencia de Tmc1 puede generar inserciones y deleciones alrededor de la mutación, las que son corregidas por el sistema de reparación de AN endógeno de la célula. De esta forma se corrige la expresión del alelo mutante. Potencialmente, esta técnica podría restaurar la audición en pacientes que tienen la misma mutación que el modelo animal y contribuir a la mejora de personas con otros trastornos autosómicos dominantes. De manera más general, el estudio proporciona pruebas de concepto de que la edición del genoma puede ser utilizada para tratar la pérdida de audición hereditaria.
Corrección de Tmc1 mutante
La pérdida de audición hereditaria es una de las discapacidades más comunes entre los recién nacidos: afecta aproximadamente 1 de cada 1.000 bebés nacidos vivos. La mayoría de las formas de pérdida auditiva hereditaria son no sintomáticas; El 80% de los neonatos afectados heredan esta condición en un patrón autosómico recesivo y en el 20% restante, la herencia muestra un patrón dominante.
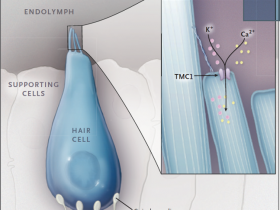
Muchas formas de pérdida de audición hereditaria son causadas por mutaciones en genes que afectan a la formación y la función de las células ciliadas cocleares -células sensoriales altamente especializadas que juegan un papel importante en la detección y procesamiento del sonido. La célula ciliada tiene haces de proyecciones similares a las del cabello, llamada estereocilia, en su superficie apical (figura 1). La deflexión de estos haces por el sonido da lugar a la apertura de canales iónicos de mecanotransducción, que se encuentran en las puntas de las estereocilios, y consecuentemente, a la despolarización de la membrana de la célula ciliada.
Las mutaciones que afectan la proteína de canal transmembrana tipo 1 (TMC1), un componente integral de la mecanotransducción, causan las formas autosómicas dominantes y recesivas de la pérdida auditiva. Recientemente, un estudio realizado por Xue Gao y colaboradores reporta la corrección de la forma dominante en un modelo de ratón de Tmc1 (llamado "Beethoven").
Figura 1. Función de TMC1 en la mecanotransducción de células ciliadas.
Se muestra una célula ciliada coclear interna con un haz de estereocilios en su parte apical. Cuando el haz de estereocilios es desviado por el sonido, los canales de mecanotransducción se abren, lo que lleva a la despolarización de la membrana celular. La proteína transmembrana tipo canal 1 (TMC1) es un componente integral del complejo de canales de mecanotransducción.
El modelo de ratón Beethoven tiene una mutación puntual (1235TA) en Tmc1 que causa la progresiva pérdida de células ciliadas y de la audición en animales heterocigotos 30 días después del nacimiento. Para prevenir la pérdida de células ciliadas y mejorar la audición, Gao y colegas usaron la técnica de edición del genoma CRISPR-Cas9 para modificar genéticamente a los roedores de manera de generar animales kcnock out para la expresión del alelo anómalo dominante. El complejo CRISPRCas9 consiste en un ARN guía que puede ser diseñado para dirigirse específicamente a una secuencia de ADN, en complemento con una enzima endonucleasa (Cas9) que hace un corte de doble cadena en el genoma (figura 2).
Una vez que el corte de la doble hebra está hecho, se pueden incorporar inserciones aleatorias y realizar deleciones gracias al propio mecanismo reparador del ADN de las células, por lo que se puede desactivar de forma efectiva el alelo objetivo. Para iniciar el proceso de edición de genes, Gao y colegas diseñaron varias guías de ARN y pusieron a prueba la capacidad de cada una para reconocer el alelo mutante Tmc1 bajo condiciones in vitro. Los autores identificaron un ARN guía que podría dirigirse de manera efectiva al alelo mutante Tmc1 sin afectar el alelo silvestre. Entonces, se inyectó este ARN en la cóclea de ratones Beethoven mutantes heterocigotos recién nacidos (0 a 2 días de edad), junto con la endonucleasa Cas9. Encontraron que el complejo CRISPR-Cas9 fue capaz de dirigirse al alelo mutante Tmc1 y generar inserciones y deleciones alrededor del lugar de la mutación, por lo tanto inhibiendo la expresión del alelo mutante. El alelo silvestre permaneció intacto para dar soporte a las funciones de mecanotransducción normal de células ciliadas. En los ratones inyectados se observó una mayor supervivencia de las células ciliadas y mejor audición que los controles no inyectados, 30 días después del nacimiento.
Figura 2. Uso de CRISPR-Cas9 para el knock down del alelo de Tmc1 mutante para restaurar la función de la célula
Se muestra la aplicación de edición del genoma al modelo de ratón Beethoven para el estudio de la pérdida de audición hereditaria. Un ARN guía, que está diseñado para dirigirse a la secuencia de Tmc1 mutada, recluta a la endonucleasa Cas9 para hacer un corte en la doble hebra del ADN. Las inserciones aleatorias y deleciones son incorporadas tras el corte, y el alelo mutante Tmc1 se desactivada.
Aunque varios estudios han demostrado que la terapia génica (en la cual el efecto de un gen mutado es compensado a través de la suplementación de una versión de tipo silvestre) se puede utilizar para mejorar la audición en modelos de ratón de pérdida hereditaria, los autores demostraron que la edición del genoma puede lograr el mismo objetivo. Lo que queda por determinar es la extensión de la supervivencia de las células ciliadas y la duración del efecto. En un estudio reciente en el que el ARN de interferencia se usó para inhibir al alelo mutante en el mismo modelo de ratón Beethoven, la mejora auditiva inicial se disipó gradualmente en la mayoría de los ratones tratados. Se desconoce si se obtendrá un beneficio más duradero con los cambios permanentes que permiten la edición del genoma.
Los datos suplementarios de los investigadores sugieren que la audición en el ratón tratado se deteriora con el tiempo. ¿Podría la edición del genoma mejorar la supervivencia de las células ciliadas y la audición en el modelo de ratón Beethoven si se entregara después del período neonatal? Los autores demostraron que la edición del genoma es posible en la cóclea del ratón adulto, pero no reportaron resultados del tratamiento en el ratón adulto de Beethoven. Esta pregunta es particularmente notable debido a que la cóclea de un ratón neonatal no está completamente desarrollada, mientras que la cóclea humana está completamente desarrollada al nacer.
Debido a que la mutación en Tmc1 en el modelo de ratón Beethoven también ha sido descrita en humanos, a futuro la implementación clínica de esta técnica podría mejorar potencialmente la audición en pacientes que tienen la misma mutación que el modelo animal y contribuir a la mejora de individuos con otros trastornos autosómicos dominantes. De manera más general, el estudio proporciona pruebas de concepto de que la edición del genoma se puede utilizar para tratar la pérdida de audición hereditaria.
Fuente bibliográfica
A CRISPR Way to Restore Hearing
Wade W. Chien, M.D.
Department of Otolaryngology–Head and Neck Surgery, Johns Hopkins School of Medicine, Baltimore.
DOI:10.1056/NEJMcibr1716789