Ceramidas interferentes de la insulina
Las ceramidas contribuyen a la lipotoxicidad que subyace a la diabetes, esteatosis hepática y enfermedades cardíacas. Mediante ingeniería genética en ratones, se ha logrado eliminar la enzima dihidroceramida desaturasa 1 (DES1), que normalmente inserta un doble enlace en el esqueleto molecular de las ceramidas y otros esfingolípidos predominantes. La ablación sistémica de DES1 en estos animales o su deleción en tejidos específicos como el hígado o tejido adiposo resolvieron la esteatosis hepática y la resistencia a la insulina causada por la deficiencia de leptina o dietas obesogénicas. Estudios que han abordado los mecanismos responsables de estos eventos revelan que la actividad de las ceramidas que promovía la absorción y almacenamiento de lípidos y la alteración de la utilización de la glucosa, no podía ser recapitulada por las (dihidro) ceramidas que carecían del enlace doble crítico. Estos estudios sugieren que la inhibición de DES1 puede proporcionar un instrumento para tratar la esteatosis hepática y los trastornos metabólicos.
Lipotoxicidad
La resistencia a la insulina (RI) está presente en la mayoría, pero no en todos los pacientes obesos y ancianos e incluso en algunas personas jóvenes y delgadas. Es un precursor y acelerador de afecciones coexistentes como la diabetes tipo 2, la aterosclerosis, la enfermedad del hígado graso no alcohólico y probablemente los cánceres asociados con la obesidad. Existe un amplio consenso de que la RI está asociada con la deposición de lípidos ectópicos en el músculo esquelético y el hígado. Sin embargo, diversos tipos de lípidos están implicados, y se debaten los mecanismos moleculares que afectan la acción de la insulina. En un modelo, un aumento del sn-1,2-diacilglicerol afecta la señalización de la insulina. En este modelo, el diacilglicerol activa una enzima intracelular (como la proteína quinasa C [PKC] isoforma ε [PKCε], una clase de isoformas dependiente de diacilglicerol e independientes de calcio [o "novedosas"]), que a su vez inhibe la capacidad de la insulina para regular directamente los procesos celulares, como la síntesis de glucógeno hepático o la inhibición de la lipólisis en el tejido adipocitario blanco (figura 1). La lipólisis desregulada promueve entonces la β-oxidación hepática y aumenta el contenido de acetilcoA en el hígado, lo que, junto con el aumento del flujo de glicerol, aumenta la gluconeogénesis hepática.
Además, un volumen sustancial de publicaciones apoya el papel de las ceramidas en la promoción de la RI. Las ceramidas, como los diacilgliceroles, son lípidos intermedios bioactivos. Pero mientras que los diacilgliceroles dan lugar a triglicéridos que almacenan energía, las ceramidas y sus derivados (por ejemplo, la esfingomielina) son lípidos estructurales de la membrana. Las enzimas específicas, llamadas desaturasas, convierten las dihidroceramidas en ceramidas, que alteran las propiedades biofísicas de las membranas. Las explicaciones para la RI asociada a las ceramidas incluyen alteraciones en la señalización de la insulina, función mitocondrial y de las vías inflamatorias. Tanto las ceramidas como las dihidroceramidas se han asociado con la RI.
Un estudio reciente de Chaurasia y sus colaboradores estableció la importancia de las ceramidas a través de la manipulación genética de la dihidroceramida desaturasa 1 (Des1, codificada por el gen Degs1) en ratones (DOI: 10.1126/science.aav3722). Una eliminación inducible de Degs1 en ratones obesos (deficientes en leptina) y delgados alteró el equilibrio energético, redujo el peso corporal y la adiposidad, y produjo los beneficios metabólicos que conlleva: disminución de la esteatosis hepática y aumento de la sensibilidad a la insulina y de la tolerancia a la glucosa. La deleción de Degs1 en el hígado y tejido adiposo, confirió modestas mejoras metabólicas sin cambios detectables en el peso corporal o en el equilibrio energético del organismo. Por último, un vector adeno-asociado que contiene un pequeño ARN con forma de horquilla, dirigido al ARN mensajero de Degs1 para la degradación, mejoró las medidas metabólicas en ratones que ya eran obesos o que tenían un peso normal, pero que posteriormente fueron sometidos a una dieta alta en grasas, con el beneficio añadido de prevenir la obesidad en estos últimos. En resumen, la eliminación de Degs1 mejoró la señalización de la insulina y la función mitocondrial y disminuyó la lipogénesis y la absorción de lípidos.
Sin embargo, estos resultados no establecen la necesidad de las ceramidas para el desarrollo de la RI. Múltiples estudios en roedores y humanos han disociado el contenido de las ceramidas hepáticas de los cambios en la sensibilidad a la insulina hepática. Por el contrario, la destrucción de PKCε, o la mutación de su residuo objetivo en el receptor de insulina, previene la RI hepática sin cambiar el equilibrio energético o afectar a los lípidos intracelulares (incluidas las ceramidas), lo que sugiere que la activación de este eje es necesaria para el desarrollo de la RI hepática. Chaurasia y colaboradores no encontraron diferencias en la concentración de diacilglicerol hepático en los ratones con deficiencia de Degs1, aunque los cambios en el grupo relativamente pequeño de diacilgliceroles bioactivos en la membrana plasmática pueden ser difíciles de detectar cuando el contenido total de diacilglicerol se mide en células totales. Sería interesante ensayar especies específicas de diacilglicerol, como sn-1,2-diacilglicerol (el tipo que activa las isoformas de PKC dependientes de diacilglicerol e independientes de calcio), en distintos compartimentos celulares purificados por fraccionamiento celular.
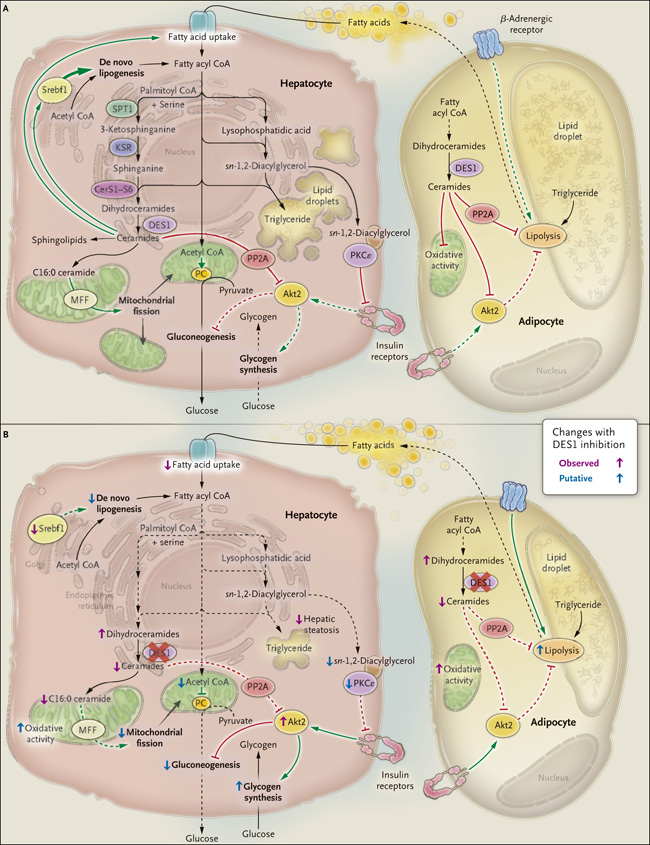
Figura 1. Lípidos y Resistencia a la Insulina Celular Hepática.
El panel A muestra los efectos del exceso de lípidos. La síntesis de ceramidas comienza con la condensación de serina y palmitoil CoA por la serina palmitoil transferasa 1 (SPT1), la reducción subsiguiente por la 3-cetosfinganina reductasa (KSR), la adición de un segundo acil CoA graso a través de isoformas específicas de la ceramida sintasa (CerS1-S6) y, finalmente, la adición de un enlace doble por la dihidroceramida desaturasa 1 (DES1). Las ceramidas sirven como precursores de otras esfingolípidos de membrana. Las ceramidas (y quizás específicamente las ceramidas C16:0 sintetizadas por CerS6) están implicadas en numerosas vías celulares, incluyendo la alteración de la función mitocondrial. Las ceramidas C16:0 interactúan con el factor de fisión mitocondrial (MFF), promoviendo la fisión mitocondrial. También se ha demostrado que las ceramidas promueven la absorción de ácidos grasos en los hepatocitos y activan genes implicados en la lipogénesis de novo, controlada por el factor de unión de respuesta al esterol 1 (Srebf1). Las ceramidas están implicadas en la activación deficiente de Akt2 ya sea a través de la proteína fosfatasa 2A (PP2A) o la proteína cinasa (PKC) isoforma ζ (no mostrado). En el hígado esteatósico, el aumento de otros lípidos ectópicos puede perjudicar el metabolismo. Los aumentos de sn-1,2-dicilglicerol en la membrana plasmática activan la isoforma de PKC ε (PKCε), lo que perjudica la señalización de los receptores de insulina. El aumento del acetilo hepático CoA activará alostéricamente la piruvato carboxilasa y, junto con el empuje del sustrato de glicerol (no mostrado) promoverá la gluconeogénesis. En el tejido adiposo, las ceramidas también pueden afectar la función oxidativa mitocondrial y, a través del PP2A, pueden afectar la señalización de la insulina y la lipólisis mediada por adrenérgicos.
El panel B muestra los efectos de la inhibición de DES1. Chaurasia y colaboradores reportaron recientemente los efectos de eliminar Degs1, el ortoólogo de DES1 en ratón. Los cambios que observaron se indican con flechas púrpuras, y otros cambios putativos se muestran con flechas azules. La inhibición de DES1 aumenta el nivel de dihidroceramidas y reduce el de las ceramidas, incluyendo las ceramidas C16:0, posiblemente disminuyendo la fisión mitocondrial. La focalización en DES1 también disminuye la absorción de ácidos grasos, la expresión de Srebf1 y sus objetivos clave, y probablemente la lipogénesis de novo. La reducción de la fisión mitocondrial mediada por ceramidas puede preservar la capacidad de la mitocondria para oxidar los ácidos grasos, lo cual es casi con seguridad clave para disminuir la esteatosis hepática. La disminución concordante del acetilo hepático CoA disminuirá la activación de la piruvato carboxilasa, mientras que la reducción del sn-1,2-diacilglicerol disminuirá las deficiencias mediadas por el receptor de insulina. Juntos, estos cambios mejorarían la acción de la insulina hepática (una disminución en la gluconeogénesis y un aumento en la síntesis de glucógeno). En los adipocitos, la focalización en DES1 mejora la actividad oxidativa mitocondrial y también puede conducir a un aumento de la lipólisis, lo que explicaría la disminución del tamaño de los adipocitos en ratones con deficiencia de Degs1.
Los modelos de RI mediada por ceramida y diacilglicerol pueden conciliarse considerando cómo afectan las ceramidas a la función mitocondrial. Por ejemplo, la miriocina, un inhibidor de la síntesis de ceramidas, mejora la sensibilidad a la insulina en ratones, pero también aumenta la actividad mitocondrial y la oxidación de ácidos grasos. Por el contrario, la sobreexpresión de la ceramida sintasa 6 aumenta los niveles de una especie específica de ceramida, conocida como ceramidas C16:0, en las membranas mitocondriales, donde interactúan con el factor de fisión mitocondrial y, por lo tanto, promueven la fragmentación mitocondrial. La ablación genética de la ceramida sintasa 6 previene el aumento de peso y la intolerancia a la glucosa en ratones, de manera similar al efecto de la focalización en DES1. Sin embargo, el silenciamiento del factor de fisión mitocondrial en ratones con sobreexpresión simultánea de la ceramida sintasa 6 previno la fragmentación mitocondrial y la intolerancia a la glucosa, a pesar de los aumentos en los niveles de ceramidas C16:0. Por lo tanto, la disfunción mitocondrial mediada por ceramidas podría explicar la asociación observada con las enfermedades metabólicas, entre las que se incluyen la neuropatía sensorial y la telangiectasia macular de tipo 2, tal como fue reportado recientemente por Gantner y sus colegas (DOI: 10.1056/NEJMoa1815111).
El aumento de la oxidación de los ácidos grasos mitocondriales disminuye el contenido de lípidos ectópicos en el hígado. Las disminuciones en la membrana plasmática de sn-1,2-dicilglicerol y acetil CoA hepática pueden mejorar la señalización de la insulina y disminuir la gluconeogénesis, respectivamente. Los desacopladores mitocondriales dirigidos al hígado aumentan la oxidación de los lípidos e invierten la RI hepática, la hiperlipidemia, la esteatosis hepática y la hiperglucemia, independientemente de los cambios en el nivel de ceramidas hepáticas que probablemente ejercen efectos más sutiles sobre el equilibrio de energía celular. Chaurasia y sus colegas encontraron que los ratones en los que Degs1 fue eliminado sistémicamente tenían un peso corporal menor que los ratones control, así como una mayor actividad mitocondrial en adipocitos aislados. Sin embargo, las diferencias en el aumento de peso corporal o el equilibrio energético no fueron evidentes en ratones en los que Degs1 fue eliminado específicamente en el hígado, tejido adiposo, o ambos. Además, la reducción de Degs1 (por ARN pequeño forma de horquilla) podría prevenir, pero no revertir la obesidad en ratones. Tal vez el aumento de la función mitocondrial, provocado por la supresión del DES1, mejora el metabolismo de la glucosa en todo el organismo al reducir el lípido ectópico y los metabolitos de lípidos intracelulares independientemente de la pérdida de peso.
La resistencia a la insulina probablemente abarca subtipos heterogéneos con mecanismos discretos, pero en la mayoría de las situaciones clínicas refleja en última instancia la acumulación de lípidos ectópicos en los órganos que responden a la insulina. En algunos pacientes, el aumento simultáneo de las ceramidas intracelulares puede perjudicar la función mitocondrial y exacerbar la acumulación de lípidos y la resistencia a la insulina. La pérdida de peso moderada puede ser efectiva en muchos escenarios, pero es difícil de lograr y mantener sin usar reemplazos de comida, medicamentos o cirugía bariátrica. Los hallazgos de Chaurasia y colaboradores son consistentes con los de estudios previos que apoyan el desarrollo de medicamentos experimentales que mejoran la oxidación mitocondrial hepática, posiblemente mediante la reducción de la biosíntesis de ceramidas (por ejemplo, mediante la inhibición de DES1 o ceramida sintasa 6) o mediante la promoción del desacoplamiento mitocondrial hepático para tratar a las personas con enfermedad hepática del hígado graso no alcohólico y diabetes tipo 2 que no pueden lograr una pérdida de peso terapéutica.
Fuente bibliográfica
Nonalcoholic Fatty Liver Disease, Insulin Resistance, and Ceramides
Varman T. Samuel, M.D., Ph.D., and Gerald I. Shulman, M.D., Ph.D
Departments of Internal Medicine and Cellular and Molecular Physiology, Yale School of Medicine.
NEJMcibr1910023