Avances en la terapia con células T
El uso de células inmunitarias modificadas genéticamente para tratar tumores es uno de los desarrollos actuales más interesantes en el tratamiento del cáncer. En este enfoque, las células T se toman de un paciente y se modifican in vitro insertando una versión modificada de un gen que codifica una proteína receptora. Esta, se conoce como receptor de antígeno quimérico (CAR, por sus siglas en inglés), que dirige la célula modificada -la célula T CAR- al tumor del paciente cuando la célula es transferida de vuelta al cuerpo. Esta terapia puede ser muy eficaz para los tumores que expresan la proteína CD19, como es el caso de leucemias agudas de células B y los linfomas de células grandes.
Células T CAR
Pese al gran interés que despierta la terapia celular, algunas personas no responden a las células T CAR y actualmente, se realizan esfuerzos para optimizar esta terapia. En un reciente artículo, Fraietta y colaboradores (DOI: 10.1038/s41586-018-0178-z) reportan la identificación fortuita de un gen que afecta positivamente la respuesta de una persona al tratamiento con células T CAR.
Las terapias en las que intervienen células inmunitarias modificadas utilizan vectores virales basados en retrovirus o lentivirus para insertar una secuencia de ADN, como la que codifica un CAR, en las células T de una persona. Sin embargo, dado que no hay control sobre dónde se inserta la secuencia en el genoma, es posible que el gen pueda insertarse en un lugar que interrumpa una secuencia importante. A principios de la década del 2000, un ensayo clínico incluyó a personas con inmunodeficiencias derivadas de la falta de una copia funcional de un gen inmunitario en particular. En el ensayo se utilizaron vectores virales para insertar una copia silvestre de este gen en sus células madre. Sin embargo, desafortunadamente varias personas desarrollaron una proliferación descontrolada de células T que evolucionó hasta convertirse en leucemia. Este evento se relacionó con la inserción del gen dentro de la secuencia de LMO2, alterando su regulación normal.
Se ha descubierto que el patrón de los sitios de integración genómica de varios vectores virales es específico para una combinación dada de vector y tipo de célula. En un estudio con personas que tenían células T modificadas mediante vectores retrovirales (DOI: 10.1126/scitranslmed.3003761) los eventos de integración no se vieron implicados como causa de cáncer. Por otro lado, los vectores lentivirales se integran aleatoriamente en el genoma pero tienden a ubicarse preferentemente en sitios con genes transcripcionalmente activos. Aunque se piensa que la integración aleatoria generalmente es segura, cualquier interrupción en el genoma confiere un riesgo de consecuencias no deseadas.
La eficacia de los tratamientos con células T CAR se ha relacionado con la persistencia y proliferación de tales células en el paciente, y esto puede verse afectado por factores como el subtipo de la enfermedad, el diseño molecular del CAR utilizado e incluso su protocolo de diseño. Fraietta y sus colegas reportaron la inusual respuesta de una persona cuyas células T CAR se dirigían a tumores que expresan CD19 -un tumor llamado leucemia linfocítica crónica. En este caso, la alteración del gen en el que se insertó la secuencia CAR tuvo un efecto directo y beneficioso en los resultados clínicos.
El paciente comenzó a mostrar una notable respuesta al tratamiento dos meses después de recibir una segunda dosis de células T CAR. La regresión tumoral ocurre normalmente dentro de un mes si el tratamiento es exitoso, así que los autores investigaron la razón del retraso en este caso.
De manera crucial, analizaron la naturaleza de las células T CAR en concentraciones máximas en la sangre durante la regresión tumoral. Fraietta y sus colegas hicieron la sorprendente observación de que estas consistían casi exclusivamente en una población clonal descendiente de una sola célula. La progenie de esta célula individual se divide con el tiempo hasta que los descendientes celulares alcanzan un punto de inflexión que elimina todo el tumor. Es preciso destacar que la dosis curativa mínimamente efectiva de esta forma de inmunoterapia puede ser la introducción de una sola célula. Esto plantea la interrogante de por qué la introducción de la secuencia CAR en esta célula T específica causa una respuesta antitumoral tan efectiva.
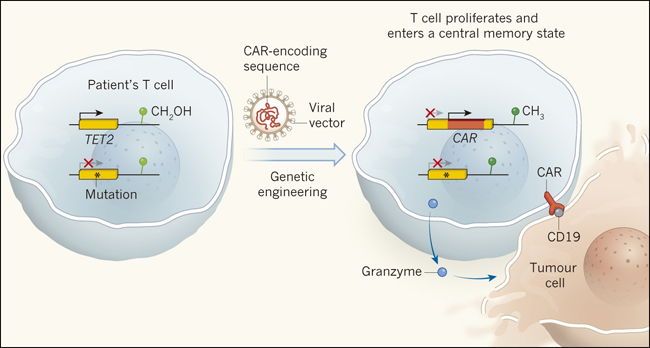
Figura 1. Tumores atacados por células T CAR.
Si las células T de un paciente están diseñadas para expresar una versión de un receptor de células inmunitarias llamado CAR (por sus siglas en inglés), estas pueden dirigirse a células tumorales que expresan una proteína específica, como CD19. Sin embargo, no todos responden a este tratamiento. Fraietta y sus colegas reportaron que la respuesta de un paciente al tratamiento con células T CAR reveló un gen que afecta el éxito de la terapia. El individuo presentaba una mutación en una de las copias del gen TET2. TET2 codifica una enzima que convierte los grupos metilo (CH3) unidos al ADN en grupos hidroximetilo (CH2OH). Este cambio se conoce como modificación epigenética. Cuando se introduce una secuencia para la codificación de CAR en las células T del paciente utilizando un vector viral, la inserción en la copia no mutada de TET2 interrumpe este gen, por lo que se genera una célula que carece de copias funcionales de TET2. Los descendientes clonales de esta célula erradicaron el tumor del paciente. La falta de TET2 alteró el perfil de las modificaciones epigenéticas de la célula, lo que puede afectar la expresión génica. Esta deficiencia de TET2 se asoció con un aumento de la expresión de factores de muerte tumoral como la enzima granzima, así como con la entrada en un estado celular llamado estado de memoria central, lo que impide que las células entren en un modo disfuncional llamado agotamiento.
En esta población clonal de células T, la secuencia CAR se había insertado en una copia de la TET2, lo que impide que el gen codifique una proteína funcional. La otra copia de TE2 tenía una mutación, por lo que la inserción de la secuencia CAR generó células T que carecían de proteína TET2. La TET2 es una enzima, también llamada metilcitosina dioxigenasa, que cataliza una reacción de hidroxilación que altera los grupos metilo adheridos al ADN (figura 1). Tales modificaciones de ADN o sus proteínas asociadas son conocidas como modificaciones epigenéticas, y pueden afectar la expresión génica en algunos casos. Cuando Fraietta y sus colegas compararon las células T que carecían de inserción CAR con aquellas en las que si se había producido, el perfil epigenético general era similar. Sin embargo, se observaron diferencias en la estructura del ADN a nivel de cromatina en los genes implicados en la función de las células T, incluyendo CD28, ICOS y el gen codificante para interferón-γ.
Las mutaciones TET2 se han asociado previamente con alteraciones clonales de las células sanguíneas vinculadas con un riesgo de enfermedad o cáncer de sangre (fenómeno conocido como hematopoyesis clonal). Sin embargo, las células T de pacientes que carecían de TET2 no dieron lugar ni a proliferación aberrante de células T ni a cáncer. Después de la eliminación del tumor, el número de células T CAR disminuyó adecuadamente, replicando su patrón normal para este tipo celular (aumentando en respuesta a su objetivo y declinando después de su eliminación).
Los autores utilizaron la ingeniería genética para eliminar TET2 en células T humanas in vitro. El análisis de estas células reveló una conexión entre la ausencia de TTE2 y la promoción y mantenimiento de las células T en un estado celular conocido como estado de memoria central. Este estado ayuda a prevenir que las células entren en un modo disfuncional llamado agotamiento, el cual se relaciona con la ineficacia antitumoral de estas. La ausencia de TE2 también se relacionó con un aumento de la memoria de células T a largo plazo.
Los investigadores observaron que las células T humanas que carecían de TET2 producían menos citoquinas que las células que tenían TET2. La perturbación de TE2 también se relacionó con un aumento en el nivel de las enzimas perforina y granzima, componentes de la la maquinaria de eliminación de tumores de las células T. Estas funciones de la TET2 en la función y memoria eran desconocidas hasta ahora.
Estos notables hallazgos podrían sugerir que enfocarse en TET2 en células T humanas a través de su inhibición mediada por medicamentos o edición genética podrían aumentar la eficacia del tratamiento con células T CAR para otros pacientes. Si esto es así, quizás la dosis de células T CAR necesarias podrían ser sólo unas pocas, en lugar de las habituales 50 millones a 500 millones de células. Esto podría acortar el tiempo de espera y reducir los sustanciales costos de fabricación. Sin embargo, dadas las asociaciones conocidas de las mutaciones TET2 con ciertos estados patológicos, este enfoque podría correr el riesgo de generar malignidad.
La mejora de la función de células T CAR es un área de investigación activa, y también se han propuesto otras opciones para lograr este objetivo. La inserción de una secuencia CAR en la localización genómica donde reside la versión silvestre del gen, aumenta la actividad y persistencia de las células T CAR en un modelo de ratón. Otros grupos han informado de progresos en hacer que las células T CAR sean resistentes a vías de señalización de puntos de control inhibitorios que dificultan su funcionamiento.
Sin embargo, los estudios clínicos son la única manera de responder a esto definitivamente. La buena noticia es que parece probable que muchos de estos enfoques pueden mejorar la eficacia y seguridad, por lo que hay esperanza de que el uso de células T CAR para tratar el cáncer será aún más exitoso en los años venideros.
Fuente bibliográfica
Tumour tamed by transfer of one T cell
Marcela V. Maus
Department of Medicine, Division of Hematology and Oncology, Harvard Medical School.
DOI: 10.1038/d41586-018-05251-5