Investigación médica
Pérdida de memoria en la enfermedad de Alzheimer
INTRUCCIÓN
La enfermedad de Alzheimer (EA) constituye la causa más frecuente de demencia y se ha convertido en un problema creciente en el área médica, psiquiátrica, neurológica, epidemiológica, social y económica, particularmente en los países con una alta expectativa de vida. Se estima que en todo el mundo existen 18.000.000 de personas con demencia.
El desarrollo alcanzado por la genética, la bioquímica y la inmunología durante los últimos años ha permitido el esclarecimiento de los sucesos patogénicos que subyacen en el trastorno degenerativo, pero en particular, se ha demostrado la especial participación de dos cromosomas, el 21 y el 17. Mutaciones en el gen de la proteína precursora amiloidea, localizado en el cromosoma 21, región 21q 11.2-q21.1, son responsables del 5 al 20 % de los casos de enfermedad de Alzheimer familiar precoz. La proteína precursora amiloidea al ser procesada por una vía amiloidogénica origina el péptido beta amiloide (βA), el cual se deposita en las placas seniles y causa efectos tóxicos directos sobre las neuronas, además de inducir la liberación de mediadores de la inflamación y radicales libres. El βA, péptido de longitud variable (de 39-43 aminoácidos) y un tamaño de 4-6 kDa, es un producto natural del metabolismo de la proteína precursora amiloidea (PPA). La PPA tiene las características estructurales de las proteínas de membrana, un largo segmento extracelular amino terminal y un corto segmento intracelular carboxilo terminal.
Por otro lado, en el cromosoma 17 se encuentra el gen que codifica la síntesis de la proteína Tau. Mutaciones en este gen provocan una fosforilación irreversible de la proteína que impide su función normal y facilitan su autoagregación, formando ovillos neurofibrilares y generando graves daños en las estructuras neuronales. Aunque aún en estudio, se acepta que el depósito de beta amiloide constituye una de las primeras causas de la patología, sin embargo, la única correlación establecida entre la intensidad de la enfermedad y las lesiones patológicas se da con los ovillos neurofibrilares.
En concreto, algunas enfermedades neurodegenerativas, como el Alzheimer, y otras demencias que se asocian con el proceso de envejecimiento, mantienen en común la merma progresiva de facultades cognitivas y, en especial, de la memoria. El hallazgo reciente de un grupo de proteínas que actúa como desencadenante de características físicas propias de estas enfermedades, podría explicar por qué se pierde la memoria e intentar nuevas aproximaciones terapéuticas.
LA FORMACIÓN DE LA MEMORIA
A menudo no valoramos cuánto necesitamos algo hasta que se nos va, y la enfermedad de Alzheimer nos ha demostrado cuán debilitante es perder la memoria. Aunque ahora se sabe bastante sobre la bioquímica de la patología, existen algunas dudas de conocimiento sobre los acoplamientos entre los pequeños cambios en las moléculas de la superficie de las neuronas y los síntomas de la enfermedad. Debido a esto, se han generado algunas ideas sobre cómo prevenir el daño al cerebro. Un reciente estudio (Gong B, Cao Z, Zheng P, et al., Cell. 2006 Aug 25; 126(4):775-88), sin embargo, sugiere una nueva manera de enfocar el déficit de memoria en pacientes que sufren la condición y las nuevas oportunidades terapéuticas. Dos moléculas han gozado de cierto prestigio en el contexto de la enfermedad de Alzheimer: el péptido beta amiloide (βA) y la forma fosforilada anormal del microtúbulo asociado a la proteína tau. La discusión sobre la importancia relativa de cada molécula, ha alcanzado ocasionalmente proporciones casi extremas, pero es posible por lo menos aproximar el curso de la enfermedad en la neurona (figura 1). Un acontecimiento inicial es la generación de βA a través del precursor de la proteína amiloidea, que alternadamente es controlada por el presenilina 1 y la presenilina 2, dos proteasas ubicadas en la membrana celular. (Las mutaciones en los genes que codifican a la proteína precursora amiloidea, a la presenilina 1 y a la presenilina 2 conducen tempranamente a la enfermedad de Alzheimer). La liberación de agregados proteicos de βA en el exterior de la célula se deposita como placas amiloideas. Más adelante, en un proceso que sigue siendo poco conocido, estos agregados desencadenan la fosforilación anormal de tau dentro de la neurona. Esta errónea fosforilación se correlaciona estrechamente con la muerte neuronal por la deposición de los agregados amiloideos, y probablemente tau desempeña un papel fundamental en la enfermedad de Alzheimer y en otros desórdenes relacionados.
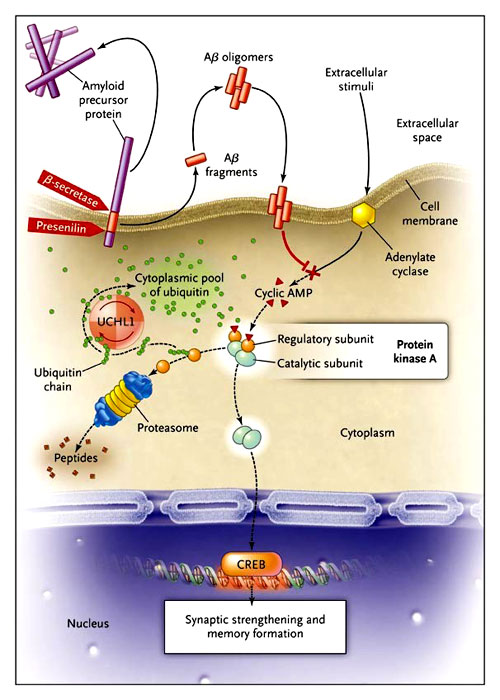
La proteína precursora amiloidea, la presenilina y la beta-secretasa generan fragmentos del péptido beta amiloide (βA) en la neurona. Estas fracciones se agrupan en oligómeros y al alojarse en las membranas dañan las uniones sinápticas. Directa o indirectamente, las especies tóxicas de βA interfieren con la producción de AMP cíclico realizada por la adenilato ciclasa. Normalmente, el AMP cíclico se une a la sub-unidad reguladora de la proteína quinasa A, la cual permite que la sub-unidad catalítica fosforile el factor de transcripción CREB (cAMP response element binding protein o proteína ligada a la respuesta AMPcíclica), conduciendo a la consolidación sináptica y, eventualmente, a la formación de la memoria. La sub unidad reguladora de la proteína quinasa A es degradada por el proteosoma. El reconocimiento de estas proteínas por el complejo proteico es apoyado por las cadenas de ubiquitina. La hidrolasa ubiquitina carboxiterminal 1 (UCHL-1) recicla las moléculas de ubiquitina, que están disponibles en una piscina citoplásmica libres de monómeros de ubiquitina. El bloqueo de UCHL1 puede interferir con la disociación de la sub-unidad reguladora de la sub unidad catalítica de la proteína quinasa A, imitando los efectos dañinos del péptido AB. El bloqueo de UCHL1 en ratones da lugar a una constitución anómala de la memoria. En cambio, el incremento de la actividad de UCHL1 antagoniza el efecto de βA y promueve la eficiente formación de memoria, por lo menos en modelos animales. Las líneas discontinuas indican pasos inhibidos en las vías.
Existen buenos modelos en ratón para estudiar simultáneamente el proceso del péptido beta amiloide, las deposiciones, la presenilina 1 y la sobre-expresión de la proteína precursora amiloidea. B. Gong y colaboradores (Universidad de Columbia, Nueva York, Estados Unidos), utilizaron el prototipo APP/PS1 y demostraron que los ratones tenían un déficit sináptico, causado probablemente por los agregados solubles de βA; esta observación coincidido con resultados de estudios preliminares. Las investigaciones han llegado a obtener conclusiones que sorprenden absolutamente y que potencialmente son muy importantes: este déficit de memoria se puede resolver en gran medida por la sobre-expresión de una segunda proteasa, la hidrolasa ubiquitina carboxiterminal 1 (UCHL-1). Abundante en neuronas, esta proteasa es un componente del mecanismo ubiquitina-proteosoma. El gripo de B. Gong modificó UCHL1 (agregándole un péptido corto) de modo que pudiera atravesar la barrera sanguínea cerebral y la membrana neuronal. Esto permitió inyectar UCHL1 en el peritoneo del ratón. El proteosoma regula la degradación controlada de las proteínas que sobran o son disfuncionales; la ubiquitina es la etiqueta molecular que tornea estas proteínas y las encaminan al proteosoma. UCHL1 tiene un papel vital en este sistema: recicla la ubiquitina de modo que esté otra vez disponible.
Resulta que el proceso de unión de la ubiquitina a las proteínas específicas en la sinapsis neuronal es crítico para mantener la plasticidad sináptica, probablemente debido a un papel del proteosoma en la flexibilidad de los niveles de diversas proteínas en el tiempo. De hecho, cuando B. Gong y colegas inhibieron el modelo APP/PS1 de ratón, observaron una supresión de la plasticidad sináptica similar a la observada en los ratones que sobre-expresaban βA. Los detalles moleculares no están totalmente claros, pero ellos comprometen a la proteína quinasa A (figura 1), la cual está implicada en el aprendizaje y la memoria y es regulada por el sistema ubiquitina-proteosoma.
¿Se debería inyectar UCHL1 a los pacientes y buscar la mejora cognoscitiva? Esto parece ser prematuro, dado que el modelo APP/PS1 no refleja todos los aspectos de la enfermedad de Alzheimer en seres humanos. Muchos modelos de la patología, incluyendo el APP/PS1, no poseen los efectos deseados de la enfermedad humana, en la cual el cerebro puede perder un tercio de su masa. En cambio, solamente algunas neuronas se pierden en los modelos de ratón. Probablemente, el modelo usado por B. Gong y colaboradores representa los primeros estadios de la enfermedad, antes de que tau esté implicada y las neuronas realmente se hayan perdido. El siguiente desafío será demostrar la ventaja de UCHL1 en situaciones en las cuales la pérdida neuronal es más extensa. Sin embargo, los resultados del equipo de B. Gong sugieren una estrategia innovadora y sorprendente capaz de poder contener la declinación cognoscitiva en pacientes con la enfermedad de Alzheimer.
Fuente bibliográfica
The Persistence of Memory
Cookson MR, Hardy J.
Laboratory of Neurogenetics, National Institute on Aging, Bethesda, MD, USA.
N Engl J Med. 2006 Dec 21;355(25):2697-8