Coloca las grasas en su lugar
El factor de crecimiento endotelial vascular (VEGF, por Vascular Endothelial Growth Factor) es una proteína de señalización implicada en la vasculogénesis y en la formación de nuevos vasos sanguíneos. De los miembros de la familia VEGF (VEGF-A,-B,-C,-D y PlGF), VEGF-B es probablemente el menos estudiado hasta el momento, ya que desde su descubrimiento en 1995, se ha visto eclipsado por su primo proangiogénico VEGF-A, principalmente por los modestos efectos antiangiogénicos del primero. Ahora, nuevas investigaciones han descubierto una importante función biológica de VEGF-B: la estimulación del transporte de ácidos grasos a través de las células endoteliales de la vasculatura.
Los resultados señalan a VEGF-B como un importante mediador para el síndrome metabólico, diabetes tipo 2 y otras indicaciones causadas por la acumulación excesiva de ácidos grasos. Considerando que VEGF-A tiene un papel bien delimitado en la vascularización de los tumores y las retinas dañadas, VEGF-B no induce la formación de nuevos vasos sanguíneos. En cambio, se cree que este factor de crecimiento ayuda a que sobrevivan los nuevos vasos sanguíneos inducidos por VEGF-A.
Metabolismo y transporte vascular de los ácidos grasos
Los trastornos metabólicos relacionados con la obesidad, tales como la diabetes tipo 2 y enfermedades del corazón, están íntimamente conectados a perturbaciones en el equilibrio sistémico de los lípidos. Los médicos a menudo se basan en el aumento de peso y la dislipidemia como advertencias de riesgo, pero los lípidos acumulados dentro de órganos metabólicos (por ejemplo, el músculo esquelético, corazón y el hígado) son fuertes predictores de un resultado adverso. De hecho, han sido identificadas varias moléculas específicas derivadas de los lípidos que son agentes de disfunción de los tejidos. Los investigadores que estudian la lipotoxicidad tratan de entender los mecanismos que gobiernan el balance lipídico y desentrañar las vías que potencian la acumulación de grasa ectópica durante la falla metabólica.
Con este fin, Carolina E. Hagberg y colegas (Nature 2010; 464:917-921) han informado de un nuevo e inesperado circuito de regulación lipídica relativo a la diafonía entre los tejidos altamente oxidantes y su vasculatura de apoyo. Los autores encontraron que el factor de crecimiento endotelial vascular B (VEGFB), producido por el corazón, músculo esquelético y tejido adiposo, se concentra en el endotelio local y favorece el transporte de ácidos grasos de la sangre, a través de la capa de células endoteliales, a los destinos metabólicos anteriormente mencionados (figura 1). El estudio ha permitido establecer un nuevo papel para VEGFB como señal paracrina que regula la entrega de lípidos a los tejidos para quemar grasa, hallazgo que plantea preguntas provocadoras acerca de la promesa de este factor de crecimiento como diana terapéutica.
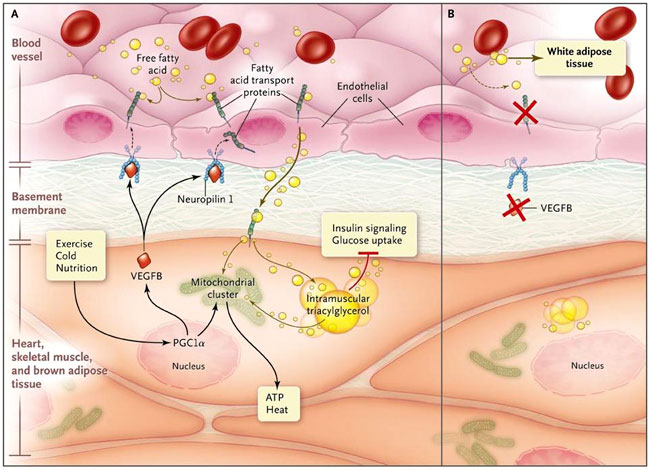
En el panel A, el corazón, músculo esquelético y tejido adiposo pardo queman los ácidos grasos que apoyan la contracción y la producción de calor. Los estímulos fisiológicos (ejercicio, exposición al frío y nutrición) activan los reguladores transcripcionales maestros, como el receptor gamma activado del proliferador de peroxisomas (PGC-1-alfa), que inducen la génesis mitocondrial y la producción del factor de crecimiento vascular endotelial B (VEGFB). VEGFB actúa sobre los receptores de superficie de la célula endotelial, como la neuropilina 1, para estimular la expresión de las proteínas transportadoras de ácidos grasos (FATP), facilitando la absorción de ácidos grasos de la sangre a través de la capa endotelial de las células. Este circuito paracrino lo coordina el metabolismo oxidativo mediante la liberación vascular de sustrato lipídico. El control de esta vía con un fármaco podría mejorar el tratamiento de la diabetes mellitus, ya que la acumulación inadecuada de triglicéridos intramusculares y otras especies de lípidos deteriora la señalización de la insulina y la absorción de la glucosa. En el panel B, la ablación genética de VEGFB mejora la utilización de la glucosa en el músculo, pero a expensas de una mayor adiposidad, ya que los ácidos grasos adicionales son redirigidos al tejido adiposo blanco.
Aunque VEGFB pertenece a una familia de reguladores vasculogénicos poco conocidos, a diferencia de sus parientes cercanos VEGFA y el factor de crecimiento placentario, tiene una potencia angiogénica sorprendentemente débil. El grupo de Hagberg obtuvo una pista de su función biológica al analizar datos de microarreglos en los patrones de expresión génica. Ellos observaron que el ortólogo de ratón del gen que codifica VEGFB, Vegfb, se encuentra agrupado en una amplia red de genes mitocondriales nucleares, sugiriendo que Vegfb y los genes mitocondriales son co-regulados. Debido a que los ratones que son completamente deficientes en Vegfb tienen masa mitocondrial normal, los autores atribuyeron la fuerte correlación entre la expresión de Vegfb y la de la agrupación mitocondrial a un interruptor de transcripción común. Los datos no publicados apuntaban hacia el receptor de estrógeno fracción alfa y a su coactivador, el receptor gamma activado del proliferador de peroxisomas (PGC-1-alfa), que son destacados reguladores maestros de la programación mitocondrial, como posibles candidatos. Carolina E. Hagberg y colegas establecieron un papel único para VEGFB en el metabolismo de los ácidos grasos, al demostrar que el factor de crecimiento se expresa con mayor abundancia en tejidos ricos en mitocondrias (por ejemplo, corazón, músculo esquelético y tejido adiposo pardo); que el tratamiento de cultivos de células endoteliales con VEGFB o la expresión forzada de la proteína en el tejido cardíaco de ratón estimula la expresión vascular de varias proteínas transportadoras de ácidos grasos, concomitante con el elevado transporte trans-endotelial de lípidos; que los ratones knock-out para Vegfb tenían disminuida la captación y almacenamiento de los ácidos grasos en el corazón, músculo esquelético y tejido adiposo; y que las acciones metabólicas de VEGFB requieren la señalización a través del receptor del factor 1 VEGFB y neuropilina 1, dos receptores de superficie celular que se expresan abundantemente en células endoteliales.
Este estudio tiene varias implicaciones. En primer lugar, los resultados se suman a la evidencia indiscutible que el equilibrio lipídico en el cuerpo y en los tejidos son profundamente dependientes de la diafonía inter-órgano. Los miocitos y adipocitos pardos son grandes consumidores de ácidos grasos. La abundante expresión de VEGFB permite a estas células transmitir esta preferencia de sustrato a los vasos locales que entregan su aporte de nutrientes. Como tal, VEGFB puede facilitar cambios fisiológicos normales en la circulación metabólica. Por ejemplo, la actividad física y la exposición al frío aumentan el catabolismo graso en el músculo y en el tejido adiposo pardo, respectivamente. La exposición repetida a estos estímulos activa PGC1 alfa, desencadenando una génesis mitocondrial y reforzando la maquinaria oxidativa local. El ejercicio muscular se adapta por el almacenamiento de triglicéridos, asegurando sustrato disponible para apoyar el alto costo de la actividad contráctil. Así, mientras VEGFA media la contracción inducida por la angiogénesis, VEGFB podría poseer un papel complementario al fomentar la expansión capilar para el transporte de lípidos hacia los músculos activos.
En contraste con un estado saludable en donde la entrega de ácidos grasos está adaptada a las necesidades metabólicas, las enfermedades manifiestan la acumulación ectópica de lípidos excediendo enormemente la demanda de energía. ¿Es VEGFB un contribuyente en tales casos? El apoyo a esta posibilidad proviene de la observación que los ratones que consumían una dieta a largo plazo rica en grasas tenían niveles elevados de ARN mensajero en el corazón. Por tanto, la obesidad y sus alteraciones metabólicas concomitantes pueden inducir la expresión de la mala adaptación de VEGFB que a su vez exacerba la lipotoxicidad y en consecuencia la disfunción de los tejidos.
¿Podría el bloqueo de VEGFB tener valor terapéutico? Como se predijo, la supresión genética de VEGFB disminuye el contenido intramuscular de lípidos neutros, presumiblemente un resultado positivo, dado que la grasa excedente afecta la señalización de la insulina y la tolerancia a la glucosa en los músculos sedentarios. En efecto, los ratones deficientes en Vegfb tenían aumentada la captación de glucosa en el tejido cardíaco, un hallazgo sugestivo del potencial antidiabético. Por otra parte, los ratones knock-out para Vegfb eran más gordos, porque los lípidos rechazados por el músculo y el tejido adiposo pardo fueron desviados hacia el tejido adiposo blanco. ¿Qué significa esto desde un punto de vista clínico? A pesar del claro panorama del efecto metabólico neto de VEGFB inactivado cabe esperar la realización de más estudios, los resultados implican que sin un cambio en la ingesta de calorías o el gasto, los fármacos diseñados para disuadir la absorción de grasa en un tejido probablemente redistribuirán la carga de energía a otro sitio. Tal vez la interpretación más simple en este momento es que el ideal farmacoterapéutico de "tener nuestro pastel y comérselo también", por error desestima la primera ley de la termodinámica. En cambio, el enfoque clínicamente probado, aunque menos atractivo, de la lucha contra la lipotoxicidad, es el que requiere menos torta y una mayor actividad.
Fuente bibliográfica
Metabolism and Vascular Fatty Acid Transport
Deborah M. Muoio, Ph.D.
Sarah W. Stedman Nutrition and Metabolism Center and the Departments of Medicine and Pharmacology and Cancer Biology, Duke University, Durham, NC.
N Engl J Med. 2010 Jul 15; 363(3): 291-293