Los canales de la fertilidad masculina
El pH intracelular es un regulador crítico de la actividad de los espermatozoides, desde que están morfológicamente desarrollados hasta el momento en que fertilizan el óvulo. Los fluidos del tracto reproductor masculino mantienen ácido el citoplasma del esperma (pH < 6,5), mecanismo primordial que permite la inmovilidad de las células maduras en reposo. Después de la eyaculación, y durante su tránsito por el tracto reproductor femenino, se inicia la motilidad espermática y, a continuación es hiperactivada para permitir que los espermatozoides penetren a través de la mucosa oviductal viscosa y rompan la protección del huevo.
Este proceso exige la alcalinización del citoplasma espermático, pero el mecanismo responsable para la extrusión de los protones a través de la transmembrana aún es desconocido, principalmente por la incapacidad para medir la conductancia de la membrana en los espermatozoides humanos.
Espermatozoides y el canal de protones
A nivel molecular, no se comprenden bien los mecanismos de señalización utilizados por los espermatozoides para emigrar al sitio de fecundación, penetrar las gruesas capas del cúmulo ovígero y la zona pelúcida, fusionarse con la membrana del huevo y activarlo. Un nuevo estudio realizado por el grupo de Polina V. Lishko (Cell 2010; 140:327-337) describe la medición de señales eléctricas del esperma humano y una vía de señalización para la fertilidad masculina.
El funcionamiento molecular de cientos de canales iónicos ha sido ampliamente estudiado en las células somáticas durante las últimas décadas, y las mutaciones en los genes que codifican estos canales se han relacionado con numerosas enfermedades. Sin embargo, los avances respecto a los canales iónicos en el esperma, han sido lentos y frustrantes. Un problema importante radica que el registro con la técnica de "patch-clamp" en células completas, método utilizado durante décadas para controlar la actividad de los canales iónicos en células somáticas, sólo recientemente ha sido aplicado con éxito en espermatozoides de ratón. Ahora, Lishko y colegas utilizaron este procedimiento para medir la corriente eléctrica del esperma humano. Al formar un sello hermético entre una pipeta de vidrio y una pequeña porción de la membrana espermática y la ruptura de la membrana aislada, pudieron monitorear la actividad eléctrica del espermatozoide.
Uno de los principales propósitos de los canales iónicos es regular la concentración de Ca2+ intracelular. Los espermatozoides usan este ión para controlar los procesos fundamentales que van desde la preparación a la reacción del acrosoma y la penetración de la capa del huevo. Canales catiónicos específicos de los espermatozoides son los denominado canales CatSper. La afluencia de Ca2+ a través de ellos es necesaria para la motilidad de los espermatozoides hiperactivados, sin lo cual no podrían trasladarse al sitio de fecundación ni penetrar la capa del huevo para lograr la fertilización. Un canal de K+ activador de la alcalinización (KSPER), formado por la proteína homóloga 3 (SLO3 o KCNU1), también es específico para los espermatozoides. Ambos tipos de canales se localizan en la cola de los espermatozoides y cada uno es expresamente requerido en la fertilidad masculina.
En células excitables de nervios y músculos, los cambios de voltaje en la membrana durante los potenciales de acción generan canales dependientes de voltaje para abrirse y cerrarse. Sin embargo, los espermatozoides no tienen potenciales de acción. Más bien, los cambios en el pH intracelular y en las concentraciones de otros mensajeros claves resultan más importantes en la apertura y cierre de los canales. Durante el viaje de los espermatozoides en el tracto reproductor femenino, los cambios de pH en el medio ambiente son dramáticos, de 4 a 7 aproximadamente, correspondiente a una reducción de la concentración de H+ extracelular por un factor de 1000. Por otra parte, el gameto masculino mantiene un bajo pH cuando están en el epidídimo, de hecho, un pH menor ayuda a mantener la inmovilidad. Las células reproductoras experimentan la alcalinización intracelular durante la preparación y son estimuladas por señales fisiológicas tales como las de la capa del huevo.
¿Cómo son alcalinizadas las unidades espermáticas? Un posible mecanismo es a través del intercambio Na+/H+, sale H+ e ingresa Na+. En particular, en los espermatozoides el intercambio Na+/H se localiza en la cola, a través de los canales CatSper y KSPER, y es necesario para la fertilidad masculina, pudiendo ser responsable la alcalinización.
Sin embargo, el descubrimiento por parte del grupo de Lishko traslada el foco de atención hacia el canal de protones HV1, que participa en la extrusión de H+ y por tanto en la alcalinización (figura 1). Los canales HV1 están controlados por cambios de voltaje en la transmembrana y los gradientes de pH, y los canales conducen selectivamente a H+. La función fisiológica de estos canales se ha caracterizado en leucocitos con actividad fagocítica, en donde existe una vía para el eflujo de H+ y la compensación para NADPH oxidasa durante el estallido respiratorio de la producción de superóxido. A diferencia de los transportadores, el movimiento de H+ a través del canal HV1 es pasivo, por lo que la alcalinización intracelular se limita a momentos en que el potencial de membrana es positivo respecto al potencial de equilibrio para los protones. A diferencia de los espermatozoides humanos, los de ratón tienen una corriente HV1 mínima, y los animales carentes del gen HV1 son fértiles.
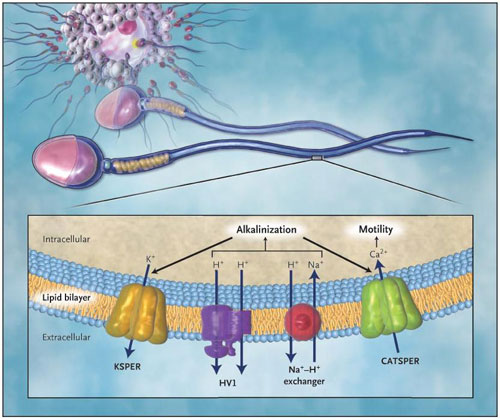
Durante la habilitación espermática y la interacción con la capa de huevo, el citoplasma de los espermatozoides se alcaliniza. Polina V. y colaboradores evaluaron directamente la actividad eléctrica de las células completas en el esperma humano, utilizando métodos de pinza y parche. Los autores encontraron que el canal de protones HV1, sensible al potencial de membrana y al gradiente de pH, es el mecanismo predominante utilizado por el esperma para lograr la alcalinización intracelular. En respuesta a este proceso, los canales KSPER abiertos permiten la salida de K+ y la hiperpolarización de la célula, mientras que los CatSper abiertos permiten la entrada de Ca2+, desencadenando la motilidad e hiperactividad. El intercambio Na+/H saca H+ para mantener la alcalinización. CatSper, KSPER y el cambio Na+/H, son procesos específicos de los espermatozoides, y la desactivación de la mutaciones en los genes correspondientes genera total esterilidad en ratones machos, en cambio, las mutaciones en las proteínas CatSper provocan esterilidad completa en hombres.
Polina V. Lishko y colegas observaron que el zinc bloquea el canal HV1, un resultado coherente con su efecto negativo sobre la función espermática. HV1 es fácilmente expresado en células no espermáticas, facilitando aún más las investigaciones moleculares y la búsqueda de sus inhibidores. Por otra parte, la técnica patch-clamp desarrollada por el estudio del grupo de Lishko permite un nuevo tipo de análisis para la calidad del esperma humano y la identificación de los defectos asociados a los canales iónicos.
Fuente bibliográfica
University of Pennsylvania, Philadelphia, USA.
Dejian Ren, Ph.D.
University of Pennsylvania, Philadelphia, USA.
N Engl J Med. 2010 May 20; 362(20):1934-5