Neurología
De la materia gris a la esclerosis múltiple
La esclerosis múltiple (EM) y la encefalomielitis autoinmune experimental (EAE) se consideran como desórdenes inmune-inflamatorios del sistema nervioso central. Con los años, varios antígenos de mielina, incluyendo la proteína básica de la mielina, la proteína proteolipidica, la proteína básica oligodendrocítica asociada a mielina, la glicoproteína de mielina de oligodendrocitos y los antígenos no mielina o astrocitarios como S100b y neurofilamentos, han demostrado ser capaces de inducir la EAE. Se han realizado estudios con proteínas y antígenos con autoantígenos de lípidos para analizar la respuesta inmune en la EM y en otras condiciones autoinmunes, apareciendo recientemente potenciales biomarcadores para los subtipos de EM. En analogía a la EAE, la heterogeneidad clínica de la EM en humanos a menudo se explica por la suposición que varios antígenos de mielina y no. En la EM humana, sin embargo, el papel exacto de estos antígenos candidatos aún está por definirse.
Formación de la lesión en la esclerosis múltiple
La esclerosis múltiple ha sido clasificada como un trastorno que afecta la materia blanca del sistema nervioso central. Los focos de desmielinización, diseminados en toda la sustancia blanca, son visibles en la inspección post-mortem del cerebro. Estos hallazgos han llevado a la percepción de que la condición es una enfermedad desmielinizante que involucra efectivamente a la sustancia blanca. En los últimos 25 años, muchos estudios de imagen de resonancia magnética (IRM) han demostrado lesiones esparcidas a través de la materia blanca que se desarrollan en el inicio de la enfermedad y se acumulan con el tiempo. Sin embargo, las lesiones, cuantificados por diferentes técnicas de resonancia magnética, se correlacionan débilmente con la discapacidad neurológica.
Esta paradoja puede explicarse parcialmente por las lesiones desmielinizantes y la enfermedad neuronal en la corteza cerebral y sustancia gris profunda. Lamentablemente, el daño en la sustancia gris no se puede detectar con el uso de secuencias de imágenes en la RM en pacientes vivos o por inspección visual del cerebro en la autopsia, lo que apoya aún más la percepción de que es una enfermedad de la materia blanca. Sin embargo, ensayos longitudinales en pacientes con esclerosis múltiple han mostrado tasas aceleradas de atrofia en la materia gris, una consecuencia de las lesiones en esa área. A principios de la enfermedad, la atrofia es 3 veces más rápida en los pacientes afectados que en los no afectados, y con la discapacidad neurológica progresiva, este ritmo aumenta 14 veces más rápido en las personas afectadas que en las no afectadas. La atrofia de la materia gris se correlaciona con más fuerza con la discapacidad física y la discapacidad cognitiva que con la atrofia de la materia blanca. Sin embargo, aún queda mucho por aclarar en relación con la enfermedad de la materia gris en la esclerosis múltiple, incluido su mecanismo o mecanismos, aclarando que depende tanto del desarrollo de marcadores de imágenes más sensibles que permitan la visualización y cuantificación de las lesiones de la sustancia gris y de la validación de marcadores biológicos de la enfermedad de la materia gris.
Un reciente artículo de Tobias Derfuss y colegas (Proc Natl Acad Sci USA 2009; 106:8302-8307), por lo tanto, es bienvenido. Los investigadores utilizaron un enfoque imparcial para identificar autoantígenos de glicoproteína en individuos con esclerosis múltiple. Este planteamiento llevó al descubrimiento de que ciertos pacientes con esclerosis múltiple, tienen anti-anticuerpos y células tipo 1 helper T (Th1) y tipo 17 T helper T (Th17) en el líquido cefalorraquídeo o en el suero que reconocen la contactina 2, el ortólogo de rata que de forma transitoria expresa la glicoproteína axonal 1 (TAG-1). En los adultos humanos, la contactina 2 se expresa en regiones especializadas de las fibras de mielina por los oligodendrocitos, células de Schwann y los axones de una subpoblación de neuronas, incluidas las del hipocampo y de la médula espinal, siendo esta distribución consistente con la idea que una respuesta autoinmune a la contactina 2 interviene en la destrucción de la mielina, axones y neuronas durante el desarrollo de la esclerosis múltiple.
Para probar esta hipótesis, el grupo de T. Derfuss transfirió células T específicas para TAG-1 en ratas. La forma leve de encefalomielitis alérgica experimental, una enfermedad autoinmune que afecta el sistema nervioso central, se desarrolló posteriormente en estos animales. Los investigadores observaron inflamación de los vasos sanguíneos de la materia gris, un resultado que estuvo ausente en los modelos clásicos de la encefalomielitis alérgica experimental inducida con proteínas de la mielina. Los autores entonces probaron un modelo de encefalomielitis alérgica experimental en ratas mediante la administración de anticuerpos contra una proteína de la mielina - la glicoproteína de la mielina del oligodendrocito - después de la administración de células T específicas para TAG-1 (anticuerpos contra la glicoproteína de la mielina del oligodendrocito se han detectado en las lesiones de los pacientes con esclerosis múltiple). Finalmente, se observó una desmielinización generalizada, tanto en la materia blanca como en la gris.
Estos hallazgos sugieren un mecanismo de desmielinización cortical en la esclerosis múltiple. Se han descrito tres tipos de lesiones desmielinizantes en la corteza cerebral de los pacientes con esclerosis múltiple en el examen post-mortem (figura 1). Las lesiones con patrón tipo I involucran a la materia blanca y gris. El patrón II son pequeñas áreas perivasculares de desmielinización cortical. El patrón tipo III son bandas de desmielinización cortical por debajo de la superficie de la piamadre que a menudo cubren varias circunvoluciones y paran en la capa cortical tres o cuatro. Existe mucha especulación de que el patrón de lesiones III estaría relacionado con los folículos inmune en el espacio subaracnoideo.
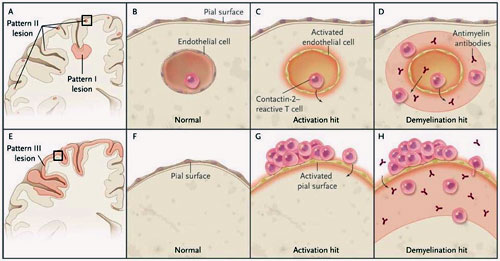
Las lesiones desmielinizantes en la corteza cerebral en pacientes con esclerosis múltiple se presentan en tres modelos, pero se desconoce cómo surgen. T. Derfuss y colegas describen un modelo de dos pasos anómalos separados, un paso de activación y otro de desmielinización, que desencadenan el proceso patológico. En el patrón de lesiones I y II (paneles de A a D), la activación puede ser causada por la circulación de células T reactivas contra la contactina 2. Estas células corticales activan la vasculatura del sistema nervioso central, permitiendo a los anticuerpos circulantes antimielina obtener acceso. Los anticuerpos antimielina regulan la desmielinización, causando desmielinización cortical. En el patrón III (grupos E a H), las células T reactivas contra la contactina 2 dentro de los folículos linfoides en el espacio subaracnoideo median el paso de activación, permitiendo que los anticuerpos antimielina originados dentro del espacio subaracnoideo accedan. Estos anticuerpos antimielina regulan la desmielinización. Áreas C y D son imágenes ampliadas de la zona A, y G y H, son imágenes ampliadas de la zona E.
Sobre la base de esto datos, T. Derfuss y colaboradores propusieron un modelo de dos pasos (two-hit model) consistente con las observaciones (figura 1). El esquema plantea que la inflamación mediada por inmunocomplejos se dirige a la contactina 2 en o cerca de las células endoteliales de la materia gris abriendo la barrera cerebro-sangre o alterando las células endoteliales en la materia gris, permitiendo que los efectores de la desmielinización (tales como anticuerpos frente a proteínas de la mielina) accedan a la materia gris. Este modelo es coherente con la conclusión de que la mayoría de las lesiones desmielinizantes de la materia gris están desconectadas de la desmielinización de la materia blanca y con la observación que existen las condiciones en las que la inflamación de la materia gris se produce en ausencia de desmielinización. Estudios futuros deberían centrarse en el modelo “two-hit” de la enfermedad cortical, en el desarrollo de marcadores biológicos y de imagen sensibles para el proceso (contactina 2 puede llegar a ser un marcador de este tipo), y en última instancia, sobre los enfoques terapéuticos respecto a la enfermedad de la materia gris.
Fuente bibliográfica
Gray-Matter Injury in Multiple Sclerosis
Richard A. Rudick, M.D., and Bruce D. Trapp, Ph.D.
Mellen Center for Multiple Sclerosis Treatment and Research, Neurological Institute, Cleveland Clinic, Cleveland, USA.
N Engl J Med. 2009 Oct 8; 361(15):1505-6