
Julio
2009.
Volumen
8
-
N
°
37
11
son el daño renal y la hepatotoxicidad.
En pacientes con EC corticodependientes en los
que el tratamiento con AZA/6-MP falló o fue mal
tolerado es de utilidad el uso de metotrexato.
No se ha demostrado su efectividad en CU. Una
ventaja por sobre la AZA/6-MP es una mayor
rapidez en la inducción de la remisión. Uno de
los efectos nocivos más importantes es la
hepatotoxicidad la cual debe ser monitorizada.
TERAPIAS BIOLÓGICAS
Infliximab es un anticuerpo monoclonal contra
TNF- . Se utiliza en pacientes con EC severa
refractaria al tratamiento en dosis de
5
mg/
kg en
3
dosis iniciales las semanas
0
,
2
y
6
y luego dosis de refuerzo cada
8
semanas.
También ha demostrado un rol en lograr
disminuir el uso de corticoides. El uso de
infliximab en niños con CU está en estudio y
trabajos preliminares han obtenido resultados
alentadores. Los efectos adversos incluyen
reacción de hipersensibilidad, mayor índice de
infecciones y activación de infecciones latentes
como tuberculosis. El mayor temor es el riesgo
aún por definir de desarrollar enfermedades
linfoproliferativas y tumores. Un factor limitante
en su uso es el desarrollo de anticuerpos
anti-infliximab, que sería menor en niños que
en adultos. El uso concomitante de terapia
inmunomoduladora disminuiría su aparición.
El futuro sugiere la identificación de nuevos
modificadores de la respuesta inmune, del tipo
biológico tales como CDP
571
, IL-
10
, IL-
11
, ISIS-
2302
, anti-
4
-ab (natalizumab), adalimumab
y también otros inmunosupresores como
tacrolimus y micofenolato. Terapias alternativas
como trasplante de médula ósea está en
evaluación para niños con EC, basado en el
hecho que la ablación de las células progenitoras
hematológicas e inmunes del huésped podría
inducir resolución de la lesión inflamatoria
en el intestino (condicionamiento), y que con
la reconstitución por las células normales del
donante, la enfermedad inmuno-mediada podría
resolverse y que posterior a la repoblación
medular y de linfonodos con las células
derivadas del donante, las manifestaciones
de inflamación podrían regresar.
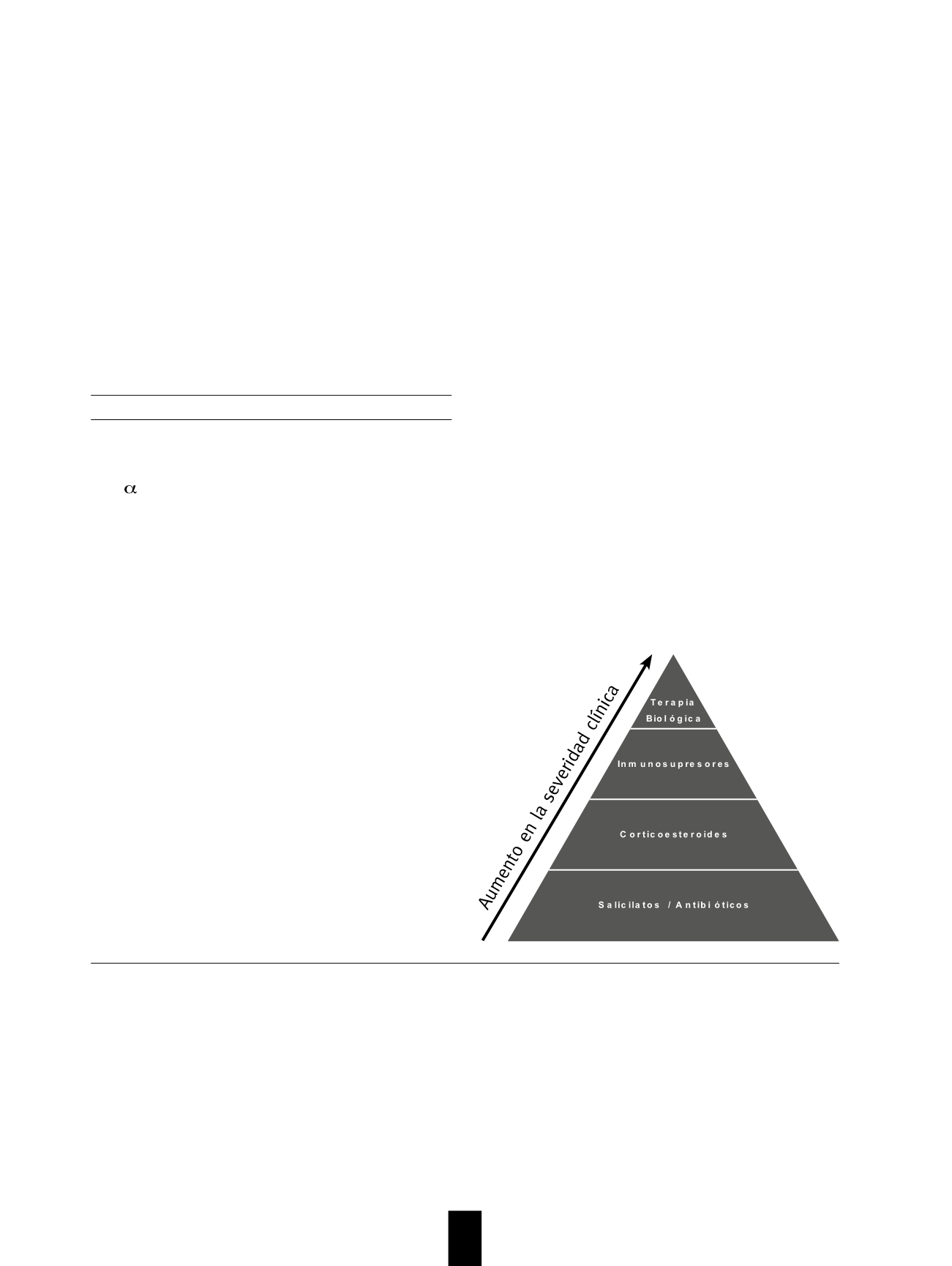
Figura
2
. Pirámide terapéutica de la EII
Referencias:
1.
Grover P and Kamat D. Management of Inflammatory Bowel Disease. Clin Pediatr (Phila)
2007; 46: 359-64
. Silverberg MS, Satsangi J,
Ahmad T, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: Report of a
Working Party of the
2005
Montreal World Congress of Gastroenterology. Can J Gastroenterol
2005;19
(Suppl A):
5A-36
A.
2.
Hyams JS. Inflammatory Bowel Disease. Pediatr Rev
2005;26:314-320.
3.
IBD Working Group of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). Inflammatory Bowel
Disease in Children and Adolescents: Recommendations for Diagnosis – The Porto Criteria. J Pediatr Gastroenterol Nutr
2005;41:1-7
.
4. Jose FA and Heyman MB. Extraintestinal Manifestations of Inflammatory Bowel Disease. J Pediatr Gastroenterol Nutr
2008;46:124-33.
5. Report of a Working Group of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the Crohn’s and
Colitis Foundation of America. Differentiating Ulcerative Colitis from Crohn Disease in Children and Young Adults. J Pediatr Gastroenterol
Nutr 2007;44:653-74.
















