Predicción del éxito de la terapia antitumoral
Los tumores que presentan deficiencia en la reparación del ADN se caracterizan por alteraciones en secuencias conocidas como microsatélites y pueden acumular miles de mutaciones. Esta alta carga mutacional hace que los tumores sean inmunogénicos y sensibles a los inhibidores de puntos de control basados en la proteína de muerte celular programada-1 (PD-1). Sin embargo, a pesar de su inmunogenicidad tumoral, los pacientes con estos tumores experimentan respuestas muy variables, y aproximadamente la mitad son refractarios al tratamiento. REcientemente se presenta evidencia experimental y clínica que muestra que el grado de inestabilidad de los microsatélites (MSI) y la carga mutacional resultante, en parte, subyacen a la respuesta variable a la inmunoterapia de bloqueo mediado por PD-1 en tumores humanos y de ratones. El grado de respuesta está particularmente asociado con la acumulación de la carga mutacional, principalmente inserciones y deleciones. Este estudio proporciona una justificación para la caracterización -a nivel genoma completo- de la intensidad de la MSI y la carga mutacional para perfilar mejor las respuestas a la inmunoterapia anti-PD-1 en el cáncer humano con deficiencia en la reparación del ADN.
Diversidad genética tumoral
Los resultados de la terapia tradicional, dirigida o la inmunoterapia para el cáncer están influenciados por las diferencias en los perfiles mutacionales del cáncer. Los tumores con deficiencia en la reparación de mal apareamiento (mismatch-repair deficiency) tienen perfiles mutacionales específicos caracterizados por una alta inestabilidad de microsatélite (MSI). (Los microsatélites son tramos de ADN formados por pequeñas repeticiones en tándem dispersas por todo el genoma humano; el número de repeticiones que componen un microsatélite determinado varía de persona a persona.) Un estudio recientemente reportado por Mandal y sus colaboradores muestra que tanto el grado de MSI en el tejido tumoral como la carga mutacional tumoral resultante, especialmente la carga de un tipo particular de mutación, se correlacionan y por lo tanto pueden ayudar a predecir una respuesta a los anticuerpos contra la proteína de muerte celular programada 1 (anti-PD-1) (DOI: 10.1126/science.aau0447).
Los microsatélites son propensos a los errores durante la replicación del ADN, que normalmente se reparan en las células normales. Sin embargo, en las células con genes defectuosos de reparación del mal apareamiento en el ADN, los "errores" se acumulan, llevando a polimorfismos de microsatélites somáticos observados en muchos tipos de cáncer, pero que son más prevalentes en el cáncer colorrectal, endometrial y gástrico. Los hallazgos de las correlaciones generales entre la deficiencia de reparación de mal apareamiento, la alta carga mutacional del tumor, la alta MSI y las respuestas a la inhibición del punto de control inmunológico condujeron a la aprobación de la terapia anti-PD-1 únicamente de acuerdo con el estado de la MSI y la reparación de mal apareamiento, en lugar de basarse en el tipo de cáncer. Sin embargo, las respuestas a la terapia anti-PD-1 varían considerablemente entre los pacientes que tienen tanto una deficiencia de reparación de errores como MSI. Cerca de la mitad de estos pacientes sólo tienen un beneficio limitado. Para delinear aún más los detalles sobre el mecanismo de las interacciones entre estos factores y para revelar los mejores predictores del beneficio de la terapia anti-PD-1 en sujetos con deficiencia de reparación del ADN, Mandal y colaboradores diseñaron una serie de experimentos en ratones. Estos experimentos fueron seguidos por análisis de resultados de secuenciación del proyecto Cancer Genome Atlas y datos clínicos de dos cohortes de pacientes.
El alto grado de heterogeneidad genética de los tumores humanos deficientes en la reparación presenta desafíos en la identificación de relaciones causales y en la cuantificación de las contribuciones de elementos individuales a la respuesta a los inhibidores del punto de control PD-1. LOs investigadores comenzaron desactivando el gen Msh2, que es indispensable para la reparación normal del mal apareamiento, en líneas celulares de melanoma y carcinoma de colon en ratones pobremente inmunogénicos (figura 1). Cuanto más tiempo se cultivaron las líneas celulares después de haber sido deficientes en la reparación, más mutaciones se acumulaban: las puntuaciones de la MSI (con puntuaciones más altas que indicaban una mayor inestabilidad genómica) de las células cultivadas durante un mes después de la inactivación de Msh2 eran intermedias, mientras que las puntuaciones de las células cultivadas durante 3 meses adicionales eran mucho más altas. Las células con un alto puntaje de MSI tuvieron porcentajes significativamente más altos de mutaciones indel (inserciones o deleciones) recientemente adquiridas que aquellas con un puntaje intermedio de MSI.
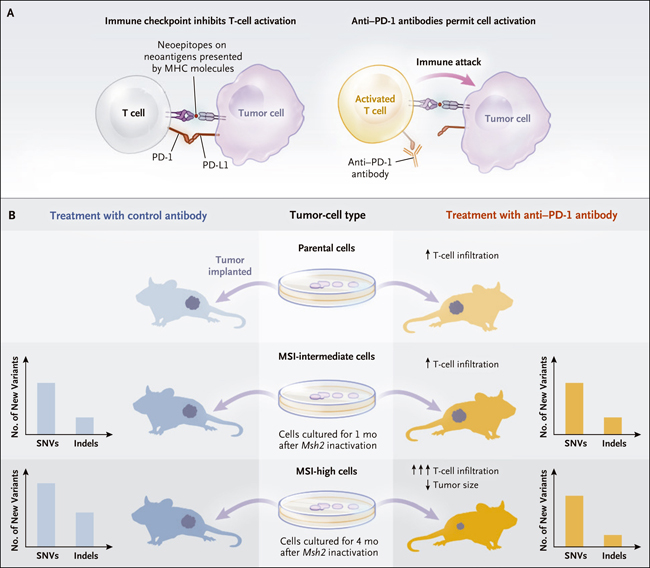
Figura 1. Inestabilidad microsatélite, mutación e inhibición de puntos de control inmunitario.
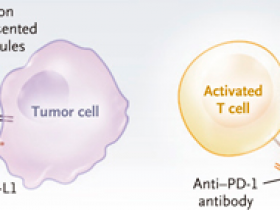
Como se muestra en el Panel A, el compromiso de la proteína de muerte celular programada 1 (PD-1) en las células T por el ligando PD-1 (PD-L1) conduce a la supresión de la respuesta inmune. Los anticuerpos PD-1 (anti-PD-1) interrumpen esta interacción, permitiendo que las células T reconozcan y ataquen a las células tumorales que expresan neoepítopos inmunogénicos. Como se muestra en el Panel B, se crearon células tumorales deficientes en la reparación de mal apareamiento a partir de líneas celulares parentales competentes a través del knock-out de Msh2 mediado por la técnica CRISPR-Cas9. Estas células deficientes en la reparación fueron cultivadas durante un mes, período en el que acumularon mutaciones y se convirtieron en células con inestabilidad microsatélite (MSI) intermedias. Los cultivos mantenidos por 4 meses se convirtieron en células con una alta MSI. Estas últimas acumularon más mutaciones -inserciones y deleciones (indels) particularmente- en comparación a las células MSI-intermedias. Después de la implantación en ratones inmunocompetentes y el tratamiento con anticuerpos control o anti-PD-1, la infiltración de células T fue mayor en los injertos tumorales con tratamiento anti-PD-1. Además, la reducción relativa de nuevas indels en tumores con alta MSI tratados con anti-PD-1 (en comparación con el número de nuevas indels en los tumores con alta MSI tratados con control) es consistente con la "inmunoedición". El número de nuevas variantes se determinó utilizando como control la secuencia del genoma de la línea celular parental. Los gráficos de barras están pensados para transmitir tendencias y no para ser precisos. MHC denota complejo mayor de histocompatibilidad y SNV, variante de un solo nucleótido.
En ratones tratados con terapia anti-PD-1, los tumores que crecieron de las líneas parental y células con MSI-intermedia tuvieron respuestas limitadas, pero los tumores de células MSI-altas tuvieron reducciones drásticas en el volumen. Estas reducciones fueron acompañadas por firmas de expresión génica de activación inmunológica en el tejido tumoral y por infiltraciones de células T mucho mayores que las de los tumores cultivados a partir de células MSI intermedias y de células parentales. La respuesta inmunitaria tuvo un fuerte efecto sobre la subpoblación inmunogénica dentro de un tumor, llevando a la desaparición de algunas de las células portadoras de mutaciones en un fenómeno denominado "inmunoedición". De acuerdo con la hipótesis de que las células con mutaciones indel tienen una mayor probabilidad de generar neoantígenos inmunogénicos que las que tienen más variantes de un solo nucleótido, y que las primeras tienen más probabilidades de ser atacadas por las células T, se observó una mayor pérdida de indels que las variantes de un solo nucleótido en los tumores de células MSI de alto nivel en ratones tratados con anti-PD-1.
Los resultados reportados por Mandal y sus colaboradores apoyan el uso de la puntuación MSI y la carga mutacional tumoral (especialmente la carga indel), que puede ser cuantificada mediante la secuenciación de ADN de nueva generación, para predecir el resultado de la inmunoterapia anti-PD-1. Estos nuevos enfoques requieren la validación en estudios clínicos independientes de mayor tamaño, y un área clave para una mayor investigación será su validez clínica en la predicción de respuestas a largo plazo. Aunque los tumores con una alta carga de mutaciones indel se redujeron con el bloqueo del punto de control inmunológico en ratones, no fueron completamente erradicados, ni fueron eliminados en la mayoría de los pacientes humanos. La inmunoedición durante la terapia puede eliminar preferentemente los subclones más inmunogénicos del cáncer, dejando atrás subclones menos inmunogénicos que pasan a formar un tumor recurrente - en cuyo caso, una terapia combinatoria con un método de tratamiento distinto a la inmunoterapia parecería estar justificada.
Fuente bibliográfica
Predicting Tumor Response to PD-1 Blockade
Li Ding, Ph.D., and Feng Chen, Ph.D.
Washington University School of Medicine, St. Louis.
DOI: 10.1056/NEJMcibr1906340