Alternativas contra el dolor neuropático
El desarrollo de la neuropatía periférica dolorosa inducida por la quimioterapia es un efecto secundario importante que limita la dosis de muchos quimioterapéuticos, incluido el bortezomib. Sin embargo, se desconocen los mecanismos subyacentes. Recientemente, se ha reportado que bortezomib causa la desrregulación del metabolismo de novo de esfingolípidos en el cuerno dorsal de la médula espinal aumentando los niveles de los ligandos del receptor de esfingosina-1-fosfato (S1PR1). En estudios preclínicos, la interrupción farmacológica de S1PR1 con múltiples antagonistas incluyendo fingolimod, bloquea y revierte el dolor neuropático. En suma, estos hallazgos establecen a S1PR1 como un objetivo para la intervención terapéutica y debido a que además fingolimod es un prometedor anticancerígeno y está aprobado por la FDA, se espera una rápida traducción clínica de estos descubrimientos.
Fingolimod y esfingolípidos
Controlar el dolor es un gran desafío clínico. La falta de analgésicos libres de efectos secundarios ha contribuido a la reciente tragedia del uso indebido de opioides y como resultado, la esperanza de vida en los Estados Unidos ha disminuido. La urgencia de la situación exige un gran esfuerzo para identificar nuevos enfoques para el tratamiento del dolor. El reposicionamiento de fármacos con eficacia analgésica aprobados por la FDA podría ser útil, dado el largo tiempo que lleva el desarrollo de un medicamento nuevo. Por lo tanto, el estudio de Salvemini y su colaboradores (DOI: 10.1084/jem.20170584) es notable en desentrañar los mecanismos que contribuyen al dolor neuropático causado por el bortezomib, una medicación anticancerosa.
El bortezomib contribuye al éxito del tratamiento del cáncer y a la supervivencia a largo plazo en pacientes con mieloma múltiple. Este dipéptido modificado se une e inhibe al proteasoma 26S (un complejo proteico citosólico que descompone las proteínas) y estimula mecanismos apoptósicos que eliminan células del mieloma. Desafortunadamente, también causa neuropatía periférica dolorosa en aproximadamente el 30% de los pacientes, y en algunos casos esto ha llevado a la suspensión del tratamiento.
En roedores, se ha encontrado en muchos estudios un vínculo causal entre los esfingolípidos (como el fosfato de esfingosina-1) y el dolor neuropático. Además, algunas mutaciones en los genes SPTLC1 y SPTLC2 - que codifican la palmitoil transferasa serina, una enzima que a su vez impulsa la síntesis de novo de los esfingolípidos - conducen a dolor neuropático en los seres humanos debido a la producción de un metabolito esfingolítico neurotóxico. Los estudios en animales, incluyendo estudios metabolómicos no sesgados de los mecanismos de dolor neuropático en la médula espinal, han resaltado la importancia de esta enzima en el dolor neuropático.
Debido a que los niveles de la ceramida lipídica proapoptótica están aumentados por el bortezomib, y debido a que la ceramida es un precursor de los esfingolípidos y por lo tanto se esperaría que aumentara los niveles de esfingosina, era lógico investigar la asociación entre el uso del bortezomib y los niveles de los metabolitos esfingolípidos. En estudios en ratas, Salvemini y sus colegas investigaron el efecto de bortezomib en el dorsal cuerno de la médula espinal, donde neuronas aferentes primarias imparten información a los nervios centrales. Observaron niveles más altos tanto de ceramida y derivados de esfingosina, tales como fosfato de esfingosina-1, y encontraron que el bloqueo de la palmitoiltransferasa serina revertía el dolor neuropático inducido por bortezomib. Estos datos confirmaron el papel de los esfingolípidos en algunos de los efectos secundarios indeseables del bortezomib.
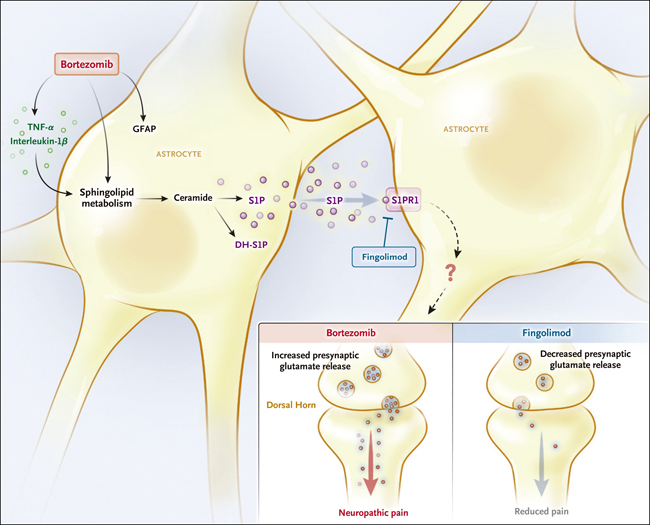
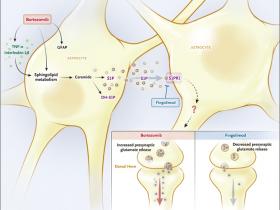
Figura 1. Astrocitos, dolor y Bortezomib - Un modelo.
Dentro de los astrocitos, el bortezomib causa un aumento en el metabolismo de los esfingolípidos, lo que lleva a un aumento en la producción de ceramida, fosfato de esfingosina-1 (S1P) y fosfato de dihidroesfingosina-1 (DH-S1P). Dentro de la periferia, el bortezomib aumenta la producción del factor de necrosis tumoral α (TNF-α) e interleukina-1β, que a su vez actúan para aumentar el metabolismo de los esfingolípidos dentro de los astrocitos. El S1P liberado se une al receptor (S1PR1) en los astrocitos, lo que finalmente lleva a un aumento en la liberación presináptica de glutamato a nivel del cuerno dorsal de la médula espinal y al desarrollo de dolor neuropático. La inhibición de S1PR1 por fingolimod fosforilado reduce la liberación de glutamato presináptico y por lo tanto reduce el dolor neuropático. GFAP denota proteína ácida fibrilar glial.
Afortunadamente, fingolimod -un antagonista funcional activo por vía oral de fosfato de esfingosina-1- ya está disponible para el uso clínico. Fingolimod impide la salida de los linfocitos de los ganglios linfáticos al sistema nervioso central. Es un fármaco oral útil para el tratamiento de la esclerosis múltiple. Conocido durante más de una década por sus propiedades analgésicas, disminuye los niveles de S1PR1, uno de los cinco receptores acoplados a proteína G activados por la esfingosina 1 fosfato. El equipo de Salvemini encontró que un antagonista específico del S1PR1 revierte el dolor neuropático y que el silenciamiento de S1PR1 con el uso de ARN pequeños de interferencia confirmó su papel como mediador del dolor en modelos animales.
Por lo tanto, el fingolimod es un tratamiento potencialmente útil para el dolor neuropático inducido por bortezomib en humanos, pero ¿podría comprometer las acciones antitumorales deseables del bortezomib? Las dosis altas de fingolimod no tuvieron tal efecto en un modelo in vitro de muerte de células tumorales y, de hecho, el fingolimod en sí tiene cierta actividad antitumoral. Por lo tanto se justifica un ensayo de prueba de concepto de los efectos del fingolimod en pacientes con dolor neuropático inducido por bortezomibin.
¿Cómo el metabolismo alterado de esfingolípidos conduce al dolor neuropático? S1PR1 se encuentra a un nivel alto en los astrocitos (figura 1), y el bortezomib induce la expresión de la proteína ácida fibrilar glial en el cuerno dorsal de la médula espinal, lo que sugiere un aumento en el número o activación (o ambas) de astrocitos. Ratones que carecen S1PR1 específicamente en los astrocitos exhiben poco dolor neuropático en el tratamiento con bortezomib. Parece que los astrocitos activados (que sintetizan y secretan la molécula neurotransmisora glutamato) estimulan el cuerno dorsal.
Apoya también esta hipótesis el hallazgo de que las corrientes postsinápticas excitatorias en las neuronas del cuerno dorsal aumentan en frecuencia y amplitud en ratas tratadas con bortezomib. La aplicación de agonistas de S1PR1 a la médula espinal también aumentó la frecuencia de estos eventos glutamatérgicos. Futuras áreas de investigación incluyen la dilucidación del mecanismo a través del cual la activación de S1PR1 en astrocitos conduce a la señalización glutamatérgica, otras vías potenciales por las que bortezomib causa dolor neuropático, y si el fingolimod tiene algún efecto sobre la neuropatía. La fascinante historia de dolor evocado por bortezomib proporciona esperanza de que el fingolimod pueda, en algunas personas, mitigar el dolor crónico.
Fuente bibliográfica
Gaining on Pain
Edward C. Emery, Ph.D., and John N. Wood, Ph.D., D.Sc.
Molecular Nociception Group, University College London, London.
DOI: 10.1056/NEJMcibr1803720