Mutación del gen KRAS con foco terapéutico
La excesiva representación de una variante silenciosa en KRAS ha llevado a explorar si esta mutación es biológicamente relevante, y si es así, evaluarla para tratar aquellos cánceres generados por mutaciones del gen.
La familia RAS de oncogenes está estrechamente relacionada (KRAS, NRAS y HRAS) y estos son los impulsores más frecuentes en la formación de un cáncer. Aunque los genes RAS se descubrieron como oncogenes humanos hace 40 años, sus proteínas han demostrado ser importantes objetivos para el diseño de fármacos: el primer inhibidor directo de una proteína RAS, sotorasib, se aprobó para uso clínico en 2021. Corresponde a un inhibidor selectivo que está cambiando la práctica clínica respecto al tratamiento de pacientes cuyos tumores tienen la mutación KRAS G12C en el codón 12 y resulta en la sustitución de una glicina por cisteína. Es mutación es inducida por fumar y es responsable de aproximadamente el 12% de los adenocarcinomas de pulmón. Sin embargo, esta forma mutante de KRAS se encuentra solo en una pequeña fracción de neoplasias con mutación RAS. Se ha avanzado en el desarrollo de otros inhibidores de KRAS mutantes específicos, sobre todo en su forma más común (mutación KRAS G12D) y en el desarrollo de paninhibidores y pandegradadores de las oncoproteínas RAS. Es probable que los inhibidores dirigidos específicamente a las oncoproteínas mutadas se asocien con una toxicidad comparativamente menor que los inhibidores pan porque no afectan las funciones normales de las proteínas RAS de tipo salvaje en todo el cuerpo. Independientemente, sigue existiendo una necesidad apremiante de nuevas estrategias con foco en las proteínas RAS mutantes en el cáncer.
Entonces, es de gran interés una reciente publicación (Nature. 2022 Mar; 603(7900):335-342) que describe una nueva estrategia para tratar pacientes con tumores que albergan mutaciones en el codón 61 de oncogenes de la familia RAS (el codón 61 es un punto crítico; las alteraciones oncogénicas ocurren con más frecuencia en este triplete que en la mayoría de los otros codones en KRAS). Los autores estudiaron los mecanismos de resistencia al osimertinib en células de cáncer de pulmón, un fármaco que inhibe la tirosina cinasa del receptor de EGF (transductor de señal clave del receptor de EGF), y que se aplica en el tratamiento de pacientes con cáncer de pulmón de células no pequeñas en los que está presente EGFR mutante hiperactivo. Para imitar algunas de las mutaciones adquiridas que pueden generar resistencia a osimertinib, los investigadores introdujeron mutaciones en KRAS en una línea celular que tenía a EGFR mutante constitutivamente activo. Se sorprendieron al descubrir que una forma fuertemente oncogénica de KRAS con el mutante Q61K que debería haber causado resistencia, no lo hizo de manera eficiente. Sin embargo, los clones celulares raros de la mutación KRAS Q61K que también tenían una segunda mutación silenciosa fortuita en un codón proximalmente adyacente (G60, que codifica la glicina) sí tenían resistencia a osimertinib. Las mutaciones silenciosas a menudo se ignoran porque solo cambian uno o dos nucleótidos en la secuencia de ADN sin modificar la secuencia de aminoácidos de la proteína codificada y, por lo tanto, no se espera que alteren la función de la proteína. Pero Kobayashi y colaboradores decidieron investigar por qué se requería la presencia de una mutación silenciosa coincidente, KRAS G60G, para que la mutación KRAS Q61K confiriera resistencia a la terapia con medicamentos.
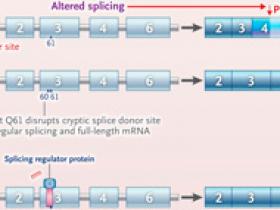
El interrogatorio de las bases de datos de secuencias del genoma del cáncer mostró que casi todos los tumores con mutaciones KRAS Q61K también contenían una alteración silenciosa en KRAS G60G, hallazgo que sugiere que el efecto oncogénico de la mutación KRAS Q61K depende de la presencia de la mutación silenciosa en el codón adyacente. Para identificar el mecanismo de esta dependencia, se examinó el ARN mensajero (ARNm) de KRAS de las líneas celulares que habían generado, descubriéndose que la alteración resultante en KRAS Q61K también provocaba un cambio en la generación (empalme) del ARNm de KRAS, de modo que el ARNm maduro, y por lo tanto la proteína, estaba truncada y no era funcional. En otras palabras, la mutación creó una versión oncogénica de la proteína dando como resultado un ARNm inestable (y, por lo tanto, ningún nivel de proteína mutante, o niveles muy reducidos). Sin embargo, el empalme aberrante del ARN se evitó cuando se introdujo la mutación silenciosa en el codón 60, lo que resultó en la producción de una proteína KRAS funcional de longitud completa con mutantes G60G y Q61K (figura 1A).
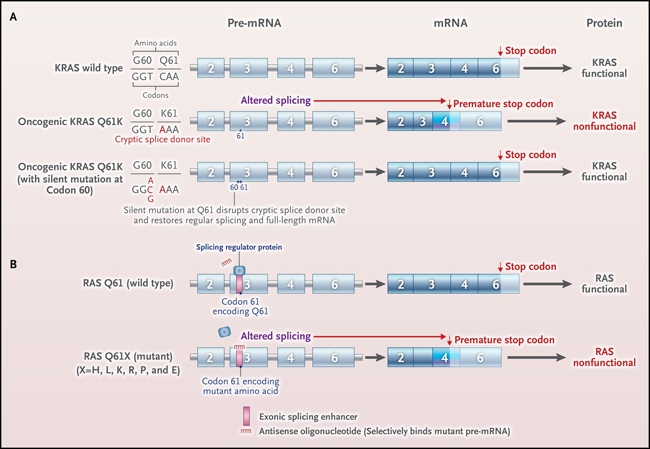
Figura 1: imitación del empalme aberrante inducido por la mutación Q61K con oligonucleótidos antisentido.
El efecto oncogénico de una variante de activación (la mutación KRAS Q61K) depende de una segunda variante silenciosa, G60, en KRAS (en el exón 4) e introducción de un codón de parada temprano (panel A). La coexistencia de una mutación silenciosa en G60 interrumpe el sitio donante de empalme críptico que introdujo Q61K, lo que produce una proteína KRAS normal de longitud completa. En RAS de tipo salvaje, las proteínas reguladoras de empalme ricas en serina y arginina (SR) se unen al motivo potenciador de empalme exónico (ESE) en el exón 3, mejorando la inclusión del exón (panel B). Los oligonucleótidos antisentido selectivos de mutantes que se unen al motivo ESE compiten con las proteínas SR para provocar un empalme anómalo del exón 3 y la proteína RAS no funcional.
Sobre la base de este conocimiento, se procedió a explorar una estrategia terapéutica que pudiera ser aplicable a todos los tumores que presenten mutaciones en el codón 61 de cualquier gen RAS. El tercer exón (un bloque de ADN que codifica aminoácidos) de KRAS, NRAS y HRAS está enriquecido con ADN que se une a proteínas específicas (reguladores de empalme) que promueve la inclusión del exón 3 en el ARNm. El bloqueo conduciría a la interrupción del empalme normal, la exclusión del exón 3 y la generación de una proteína RAS no funcional. Para probar esta posibilidad, se diseñaron oligonucleótidos antisentido que bloquean al ARNm mutante de RAS Q61 pero no a los del ARNm de tipo salvaje. El crecimiento de las líneas celulares que dependían de la expresión del oncogén RAS se inhibió cuando las líneas celulares se trataron con los oligonucleótidos antisentido, validando así la estrategia. De manera similar, el crecimiento de líneas celulares de cáncer mutantes KRAS Q61 como xenoinjertos en ratones se inhibió después de la inyección intratumoral de uno de estos oligonucleótidos (figura 1B).
El potencial para apuntar a la regulación del empalme en el exón 3 de los oncogenes RAS como estrategia terapéutica en el cáncer depende de varios factores. Primero, ¿qué tan frecuentes son las mutaciones del exón 3 en los oncogenes RAS? Aunque las mutaciones de KRAS Q61K representan menos del 0,5% de todas en KRAS, algunas Q61, como las de histidina o arginina, son más comunes, aunque menos del 5% del total. En HRAS, las mutaciones Q61 son más comunes (alrededor del 37 % del total), pero el porcentaje general de mutación HRAS en el cáncer es bajo (1,3 %). NRAS es probablemente el objetivo más atractivo para la regulación del empalme, porque el 63% de sus mutaciones ocurren en el codón 61, y estas son particularmente comunes en el melanoma y en los cánceres mieloides.
En segundo lugar, ¿qué tan factible sería que los oligonucleótidos que interrumpen la maquinaria de empalme se introduzcan en los tumores? La administración eficaz de medicamentos basados en oligonucleótidos ha sido extremadamente desafiante y muchos ensayos clínicos han fallado, incluido uno con oligonucleótido antisentido dirigido a KRAS. La entrega efectiva también puede ser un desafío en el laboratorio, los investigadores no observaron ningún cambio importante en el volumen de tumores establecidos en ratones cuando el oligonucleótido se administró por vía intravenosa. Por otro lado, fuera del contexto del cáncer, los oligonucleótidos antisentido han sido aprobados para el tratamiento de algunas enfermedades genéticas, como la distrofia muscular de Duchenne. En la mayoría de estas condiciones, la modulación parcial de la función de la proteína diana en un número relativamente pequeño de células puede producir beneficio clínico. Sin embargo, resultados anteriores con el uso de inhibidores de la vía RAS indican que es necesaria una fuerte inhibición en casi todas las células tumorales para que se produzca un beneficio clínico. Aunque la tecnología de los fármacos en base a oligonucleótidos avanza rápidamente, su utilización terapéutica para la supresión de la señalización oncogénica de KRAS sigue siendo teórica.
Las aplicaciones clínicas de este trabajo son distantes, la perspectiva de la maquinaria de empalme de ARN como objetivo en el tratamiento de cánceres con mutación RAS no debe descartarse. De hecho, el desarrollo de inhibidores de empalme específicos de moléculas pequeñas en el exón 3 de los oncogenes RAS es una estrategia candidata para la creciente propuesta de enfoques que se están buscando para atacar los cánceres con RAS oncogénico. Finalmente, este estudio es un ejemplo de la importancia de tener los recursos para investigar hallazgos inesperados, un punto que debería resonar con todos los científicos y patrocinadores de la investigación.
Fuente bibliográfica
The Potency of a KRAS Silent Variant
Miriam Molina-Arcas, Ph.D., and Julian Downward, Ph.D.
Francis Crick Institute, London.
N Engl J Med 2022; 386:2523-2525