Terapia génica contra la enfermedad de Krabbe
La enfermedad de Krabbe (o leucodistrofia de células globoides) es un trastorno degenerativo que afecta al sistema nervioso. Es causada por la falta (deficiencia) de una enzima llamada galactosilceramidasa, afectando el crecimiento y mantenimiento de la mielina, la cubierta protectora alrededor de ciertas células nerviosas que garantiza la rápida transmisión de los impulsos nerviosos. Es parte de un grupo de trastornos conocidos como leucodistrofias, que resultan de la desmielinización. Este trastorno se caracteriza también por la presencia anormal de células globoides, unidades con forma de globo, que por lo general tienen más de un núcleo.
Los síntomas comienzan antes de la edad de 1 año (la forma infantil). Signos y síntomas iniciales suelen incluir irritabilidad, debilidad muscular, dificultades de alimentación, episodios de fiebre sin ningún signo de infección, postura rígida y lentitud en el desarrollo mental y físico. A medida que progresa, los músculos continuarán debilitándose, afectando la capacidad del niño para moverse, masticar, tragar y respirar. Los afectados también experimentan pérdida de la visión y convulsiones. Con menos frecuencia, el inicio de la condición se puede producir en la niñez, adolescencia o edad adulta (formas de inicio tardío). Los problemas visuales y dificultades para caminar son las señales iniciales más comunes para esta forma, sin embargo, los signos y síntomas varían considerablemente entre los individuos afectados. Esta condición se hereda dentro de un patrón autosómico recesivo, lo que significa que ambas copias del gen en cada célula tienen mutaciones. Los padres de un individuo con una condición autosómica recesiva llevan cada uno una copia del gen mutado, pero generalmente no muestran las características de la enfermedad.
Leucodistrofia y terapia genética con un regulador de intensidad
La leucodistrofia de células globoides, también conocida como enfermedad de Krabbe, es un trastorno autosómico recesivo lisosomal causado por una deficiencia funcional de la enzima galactocerebrosidasa (GALC), la que degrada el galactocerebrósido a ceramida y galactosa. Sólo la infusión de células madre hematopoyéticas alogénicas es capaz de generar ciertos beneficios en pacientes seleccionados. Sin embargo, un reciente estudio de Bernhard Gentner y colegas (Sci Transl Med 2010;2: ra84-ra84) sugiere que un enfoque diferente podría tener un efecto terapéutico en los paciente que sufren de esta devastadora enfermedad.
La leucodistrofia de células globoides, que tiene una incidencia de 1 en 70.000 a 1 en 100.000 personas, se caracteriza por una pérdida progresiva de la mielina central y periférica, espasticidad, neuropatía y demencia, lo que lleva a un estado vegetativo crónico. La forma de aparición temprana se produce en la infancia y con frecuencia conduce a la muerte dentro de 2 años. La forma tardía ocurre en niños mayores y adultos de cualquier edad. También es mortal, pero suele tener un curso más largo de progresión en comparación a la forma temprana.
En la década de 1990, para el tratamiento de este trastorno, se empezó aplicar el trasplante alogénico de células madre hematopoyéticas, basado en el concepto de corrección metabólica cruzada en donde se toma la enzima lisosomal de una célula y se coloca en la célula adyacente que es deficiente para la enzima. Aunque el trasplante no ha demostrado ser eficaz en los pacientes sintomáticos con enfermedad infantil, los resultados en personas con enfermedad de inicio tardío son alentadores. El trasplante alogénico de células madre, sin embargo, se asocia a una elevada morbilidad y mortalidad. Las altas dosis de quimioterapia con o sin irradiación, la inmunosupresión prolongada, las complicaciones inmunológicas de rechazo del injerto y la acción del injerto contra el huésped tienen profundos efectos secundarios, lo que claramente limita la eficacia del tratamiento. Sin embargo, estos prometedores resultados han establecido la viabilidad y la eficacia de la corrección metabólica cruzada y apoyado la búsqueda de esquemas terapéuticos alternativos para la entrega de la enzima a al sistema nervioso central y periférico. El uso de la terapia de reemplazo enzimático por vía intravenosa (ERT) para los trastornos de depósito lisosomal está bien establecido, pero hasta ahora, la ERT intravenosa ha sido ineficaz en el logro de la entrega adecuada de la enzima en el cerebro.
Existe una tercera estrategia: la terapia génica. Su objetivo es la introducción de ADN en una célula diana específica para que codifica una versión normal de la proteína lisosomal ausente o defectuosa, que, a su vez, idealmente, llegue a una producción sostenida de los productos génicos de interés en los tejidos afectados, suficientes para alterar el curso de la enfermedad. A pesar que la entrega directa del vector al sistema nervioso central es invasiva y probablemente genere una distribución restringida, la administración intravenosa de células madre hematopoyéticas autólogas corregidas genéticamente permite una amplia distribución y podría proporcionar el reemplazo de la enzima de por vida, incluyendo al sistema nervioso central del sistema. Previamente se ha demostrado que las células madre hematopoyéticas dan lugar no sólo a eritrocitos, plaquetas y leucocitos, sino también a células endoteliales, macrófagos perivasculares y microglia en el sistema nervioso central. Se cree que la microglia es capaz de servir como una fuente continua de la enzima al cerebro. Y así, con la microglia corregida genéticamente, se podría suministar a largo plazo de una enzima al sistema nervioso periférico y central, cumpliendo con todos los beneficios observados con las células madre alogénicas pero sin los graves riesgos inmunológicos. Por otra parte, las células madre autólogas son fáciles de obtener.
Sin embargo, rara vez se pueden traspasar los descubrimientos en ciencia básica a la atención clínica. El grupo de B. Gentner encontró que la sobreexpresión forzada del gen que codifica GALC es tóxica para las células madre de ratón y de humanos y sus progenitores, pero no para su progenie diferenciada. Una nueva herramienta terapéutica potencialmente poderosa para regular la expresión génica es el uso de microARN, que son pequeños ácidos ribonucleicos no codificantes que pueden bloquear la traducción del ARN mensajero de destino o causar su degradación directa. A través de una serie de experimentos, ellos demostraron que un microARN específico, ubicado en las células madre hematopoyéticas, pero no en el progenie diferenciada (incluyendo microglía), podría regular a la baja la expresión de un GALC genéticamente modificado que contenga el gen que codifica la GALC precedida por un microARN de secuencia objetivo (figura 1).
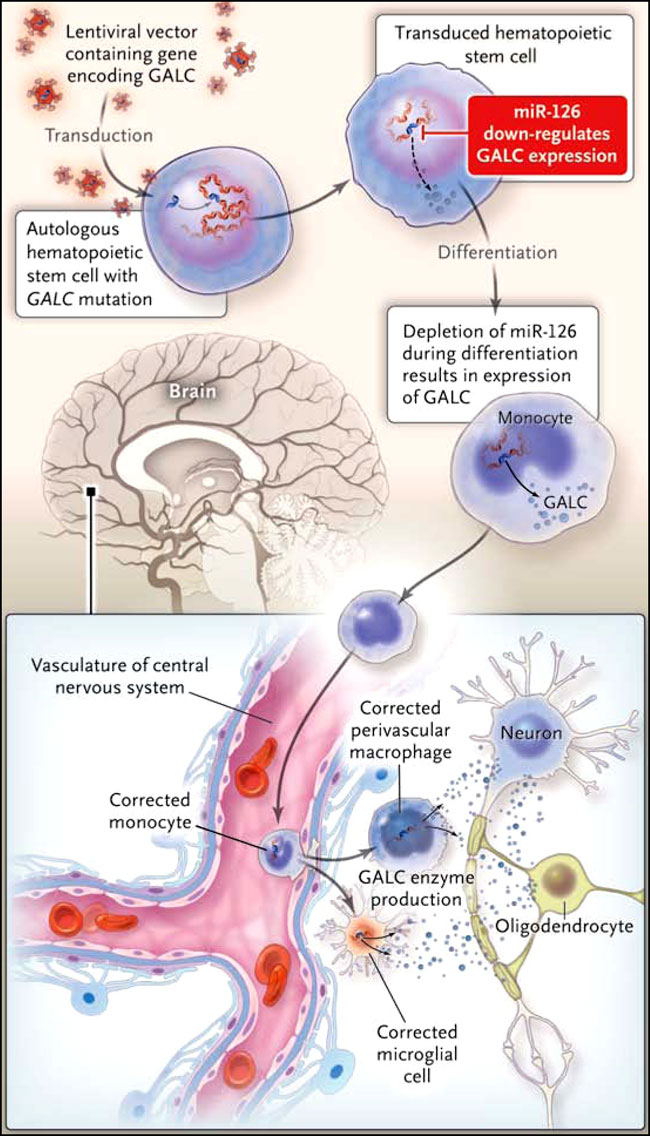
Se ha propuesto recientemente un nuevo enfoque para el tratamiento de leucodistrofia de células globoides, condición causada por una mutación en el gen que codifica la galactocerebrosidasa (GALC). Se utilizó un vector lentiviral para insertar este gen en células madre hematopoyéticas autólogas (HSC). Después de observar un efecto tóxico de la expresión constitutiva de altos niveles de GALC en células madre, los autores desarrollaron un método que aprovecha un microARN endógeno para suprimir la expresión GALC en esas células y sus primeros progenitores. Debido a que las poblaciones de células diferenciadas que se derivan de las células madre no expresan este microARN endógeno, la enzima GALC se desarrolla en estos tipos de células diferenciadas, que circulan por todo el cuerpo del ratón mutante, y algunas migran al cerebro, donde probablemente permanecerán como macrófagos perivasculares y microglia. Bernhard Gentner y colegas observaron una asociación entre la supervivencia de los animales mutantes tratados y el número de vectores copia en la médula ósea y los niveles de actividad de GALC en el cerebro.
Esta construcción es análoga al regulador de intensidad de los hogares, lo que aumenta o disminuye la cantidad de luz simplemente por el control de la potencia de salida. Sin embargo, a veces sólo necesitamos una luz continua, de la misma manera como los altos niveles de expresión GALC en la progenie diferenciada de las células madre son necesarios para mantener un suministro de GALC a las células neuronales, en el misma manera que bajos niveles de expresión GALC son apropiados para las células madre hematopoyéticas para evitar los efectos adversos de la sobreexpresión. B. Gentner y colegas encontraron que la actividad GALC fue elevada en los cerebros de los ratones tratados después del trasplante con las células madre modificadas genéticamente y observaron que los animales vivieron más que los controles no tratados.
En resumen, estos resultados proporcionan una prueba de la terapia génica mediante un "regulador de intensidad". Incluso si otros investigadores replicaran dicho trabajo, la aplicación clínica aún enfrenta muchos obstáculos, incluyendo una creciente escala tecnológica, la producción del vector y las células bajo buenas prácticas de manufactura, y el correcto rendimiento de los ensayos clínicos.
Fuente bibliográfica
Leukodystrophy and Gene Therapy with a Dimmer Switch
Paul J. Orchard, M.D., and John E. Wagner, M.D.
From the Department of Pediatrics and the Bone and Marrow Transplant Program, University of Minnesota Medical School, Minneapolis.
N Engl J Med 2011; 364:572-573