Memoria, receptores del glutamato y sinapsis
En el sistema nervioso central de los mamíferos, la transmisión en las sinapsis excitatoria es regulada principalmente por el aminoácido glutamato, a través de los receptores postsinápticos AMPAR y NMDAR. La transmisión sináptica basal está mediada por los AMPAR, que son rápidamente activados por el glutamato, mientras que los NMDAR, más lentos, regulan diversas formas de plasticidad sináptica. Gran cantidad de evidencia indica que NMDAR es esencial para un tipo específico de plasticidad sináptica: la potenciación a largo plazo (LTP, por sus siglas en inglés) en la sinapsis colateral de Schaffer CA1, dependiente del hipocampo para el aprendizaje y la memoria.
El núcleo de NMDAR es un heterotetrámero que comprende dos subunidades NR1 y dos subunidades NR2(AD). Estas subunidades están incrustadas en un complejo multiproteico que incluye más de 70 proteínas ligadas a NMDAR. Un tema emergente en la biología de NMDAR es que las proteínas asociadas a su núcleo pueden tener importantes funciones en el tráfico, la estabilidad, la composición o en la función de los NMDAR, siendo críticas en la plasticidad sináptica, el aprendizaje y la memoria.
Memoria y receptores NMDA
El receptor NMDAR [N-metil-D-aspartato (NMDA)] es el principal dispositivo molecular para el control de la plasticidad sináptica y la función de la memoria. Por lo tanto, entender mejor su control y acción en la sinapsis central puede proporcionar pistas para futuras estrategias terapéuticas en el tratamiento de los trastornos de la memoria. La memoria espacial y la memoria episódica, a menudo afectadas en personas con Alzheimer, dependen de forma crítica del hipocampo - en particular de la zona CA1, tanto en humanos como en animales de laboratorio. Por ejemplo, el bloqueo de NMDAR en el cerebro de ratón afecta la plasticidad sináptica y compromete el aprendizaje y la memoria. Por el contrario, la mejora genética de la función de NMDAR optimiza la memoria en ratones adultos.
La activación de los NMDAR, un canal iónico excitatorio en el sistema nervioso central, depende de un par de eventos coincidentes: la unión de su ligando natural (glutamato) y la despolarización. El NMDAR constituye el principal mecanismo celular responsable de iniciar muchas formas de plasticidad sináptica en las diferentes áreas del cerebro. Se trata de un heterotetrámero que consta de dos subunidades NR1 y cuatro subunidades NR2: NR2A, NR2B, NR2C, y NR2D. Las subunidades NR2 en el hipocampo y la corteza de los adultos suelen ser NR2A y NR2B, y la proporción de NR2B/NR2A disminuye con la edad en diversas especies animales (incluidas las personas) a partir del inicio de la madurez sexual. La composición de NR2 regula las propiedades de los canales NMDAR y el grado de plasticidad sináptica, con una relativa abundancia de NR2B en el cerebro de los más jóvenes confiriendo una mayor plasticidad en comparación al cerebro adulto. El núcleo tetrámero se asocia con un complejo multiproteico que incluye más de 70 proteínas asociadas, muchas de las cuales influyen en el transporte, la estabilidad, la composición o la función de los NMDAR.
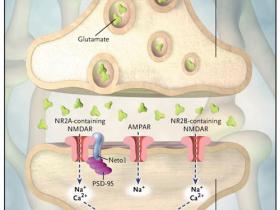
En un estudio reciente, David Ng y colaboradores (PLoS Biol 2009; 7:e41-e41) demostraron que Neto1, una proteína transmembrana sináptica que está asociada con NMDAR, interactúa con el receptor bivalentemente. El dominio intracelular de Neto1 se une a la proteína sináptica PSD-95 que a su vez se liga al receptor, y el dominio extracelular de Neto1 interactúa con NR2A y NR2B (Figura 1).
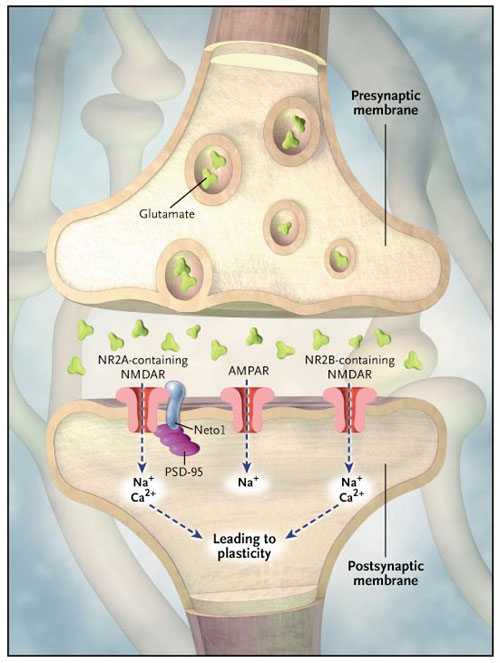
Varios experimentos sugieren que la formación de la memoria implica dos tipos de receptores de glutamato: el receptor N-metil-D-aspartato (NMDAR) y el receptor ácido propiónico alfa-amino-3-hidroxi-5-metil-4-isoxazol (AMPAR). Ambos se ubican en la superficie de las neuronas postsinápticas. AMPAR permite el flujo de sodio en la célula postsináptica, lo que resulta en una despolarización. NMDAR es permeable a los iones de sodio y de calcio. La posterior entrada de calcio iónico en los terminales postsinápticos a través de NMDAR activa cascadas bioquímicas que desencadenan la sobre-regulación de AMPAR en la membrana, aumentando la sensibilidad de AMPAR al glutamato y, por tanto, fortaleciendo las sinapsis. El presente estudio demuestra que la supresión de Neto1 da lugar a la carencia de plasticidad sináptica y menor cognición. Neto1 se une a PSD-95, una proteína que se encuentra casi exclusivamente en la densidad postsináptica de las neuronas, y es importante en el anclaje de las proteínas sinápticas. Neto1 también se adosa a NR2A y NR2B, dos isoformas de NR2 que son esenciales para las funciones de NMDAR. La composición de NR2A y NR2B en los receptores NMDAR modula principalmente sus propiedades de canal. La estimulación de AMPAR compensa parcialmente el déficit causado por la supresión de Neto1.
Para evaluar la función fisiológica de Neto1, el grupo de Ng generó ratones mutantes deficientes en Neto1. La comparación con animales tipo salvaje mostró que la expresión total de NR1, NR2A, NR2B y PSD-95 fue la misma en el hipocampo, pero que NR2A sináptica (y no NR2B) se redujo en los ratones mutantes. Esta disminución selectiva sugiere que Neto1 puede ser necesaria para lograr una concentración normal de NR2A sináptica contiendo NMDAR, y apoya la hipótesis de la existencia de diferentes mecanismos implicados en el procesamiento de NR2A y NR2B. Los autores también observaron un defecto importante en la potenciación a largo plazo de CA1 en ratones mutantes. A pesar de que éstos se desempeñaban de manera similar a los ratones salvajes en los ensayos de laberinto y en el reconocimiento de nuevos objetos, demostraron errores en las pruebas más complejas de aprendizaje y la memoria.
Como las subunidades de NR2B están presentes en los cerebros de ratones mutantes, y en el control de la plasticidad sináptica mediada por NMDAR y la formación de la memoria, los autores estimaron que el déficit en animales carentes en Neto1 podría ser compensado farmacológicamente por la prolongación de los impulsos excitorios generados por el receptor AMPA (el otro tipo principal de receptor excitatorio en la membrana postsináptica). Por lo tanto, ellos administraron ampakina CX546, generando un segundo aumento de NMDA que permitió aliviar el bloqueo de magnesio de NMDARs que contenía NR2B.
De hecho, la aplicación CX546 compensó con éxito el déficit en la potenciación a largo plazo y en el aprendizaje espacial en ratones mutantes, y no tuvo efectos sobre los animales tipo salvaje. Ng y colegas afirmaron que este fue el primer trabajo de una solución farmacológica a un problema grave de NMDAR. Más importante aún, este estudio sugiere que el fortalecimiento de la función de NMDAR que contiene NR2B puede superar los defectos heredados en la plasticidad y restauración de las funciones de memoria. Otras estrategias para impulsar las funciones de los receptores NMDA que contengan NR2B implicará la manipulación de la vía de transporte de NR2B o la modulación de los niveles de magnesio en el líquido cefalorraquídeo a través de la dieta.
El estudio del grupo de David Ng tiene importancia para los enfoques terapéuticos en los trastornos cerebrales con reducción de las funciones de NMDAR, como la esquizofrenia y la enfermedad de Alzheimer. Por ejemplo, un análisis sugirió una asociación entre un polimorfismo en la región promotora de NR2B, la reducción de los niveles de expresión de NR2B, y un aumento del riesgo de Alzheimer. Dicho esto, el procesamiento de la memoria es mucho más complicado en seres humanos que en ratones, y las alteraciones que afectan el cerebro suelen tener diversas causas. Los resultados positivos obtenidos con el uso de un ratón mutante no necesariamente se traducen en los mismos efectos con el uso de un enfoque similar en el tratamiento de las enfermedades humanas.
Fuente bibliográfica
Memory and the NMDA Receptors
Fei Li, M.D., Ph.D., and Joe Z. Tsien, Ph.D.
Brain and Behavior Discovery Institute, Medical College of Georgia, Augusta, USA.
N Engl J Med. 2009 Jul 16;361(3):302-3