Errores cromosómicos pueden dificultar algunos tumores agresivos
Los defectos en el genoma derivados de la separación incorrecta de los cromosomas (y el ADN empaquetado en su interior) en cada división de las células impulsan el crecimiento tumoral y la resistencia a la terapia.
El cáncer de próstata metastásico (CaP) sigue siendo una de las principales causas de muerte entre los hombres de todo el mundo. A pesar de la eficacia de los tratamientos, como la quimioterapia dirigida contra el receptor androgénico (RA) o con taxanos el CaP evoluciona inevitablemente hacia un estado refractario al tratamiento. La resistencia es consecuencia de mecanismos de recableado celular que pueden surgir como respuestas adaptativas impulsadas por factores de transcripción (FT).
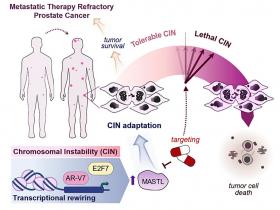
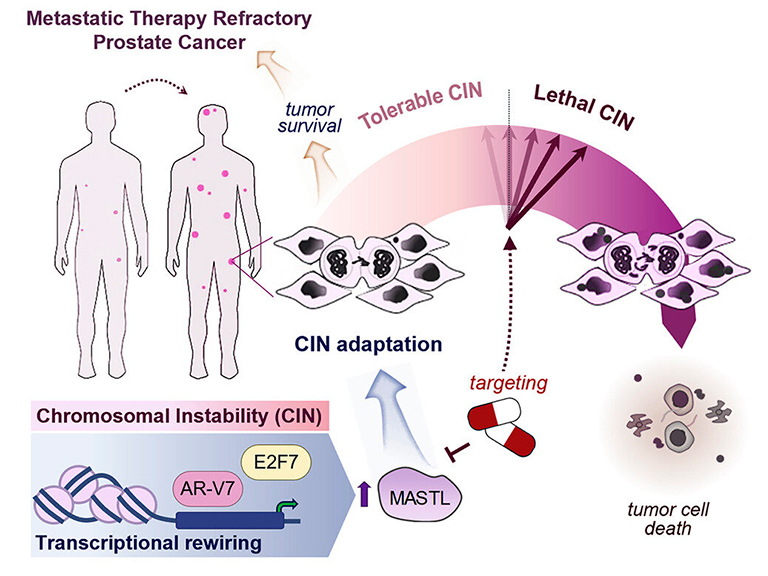
En un estudio de investigación. la doctora Verónica Rodríguez-Bravo, bióloga molecular y de células cancerosas de la Clínica Mayo y su equipo identificaron un "freno" utilizado por las células tumorales que les permite sobrevivir a la alta inestabilidad cromosómica y volverse más agresivas. Los investigadores también descubrieron que los tumores de cáncer de próstata resistentes a la terapia presentan la mayor inestabilidad cromosómica en comparación con otros tipos de tumores. Si en el futuro se desarrollaran terapias para mantener la inestabilidad -es decir, frustrar el efecto de "frenado"-, las células cancerosas podrían dejar de crecer y sobrevivir.
Los investigadores estudiaron modelos experimentales preclínicos derivados de pacientes, combinados con análisis de datos de pacientes. El equipo descubrió que las células de cáncer de próstata con un alto nivel de inestabilidad cromosómica activan genes específicos que impiden que las células adquieran más errores lo que garantiza que las células cancerosas sobrevivan y sigan promoviendo el crecimiento tumoral. Así, los tumores agresivos y resistentes a las terapias pueden evitar alcanzar niveles catastróficos de errores genómicos que los matarían.
Los hallazgos indican que los tumores metastásicos que habían sido tratados con antiandrógenos y quimioterapia (taxano) muestran una mayor expresión génica de FGA/CIN y quinasa de fidelidad mitótica. Los análisis fosfoproteómicos y funcionales señalaron un papel clave de MASTL como quinasa accionable de máxima regulación a la que las células de PCa quimiorresistentes se vuelven selectivamente adictas para sobrevivir evitando la acumulación de una carga extremadamente alta de aberraciones cromosómicas. MASTL tiene un papel establecido en la regulación del ciclo celular y la mitosis, se ha asociado con el cáncer y se ha propuesto como posible diana terapéutica, pero los mecanismos subyacentes a su desregulación y función en el CaP siguen siendo desconocidos.